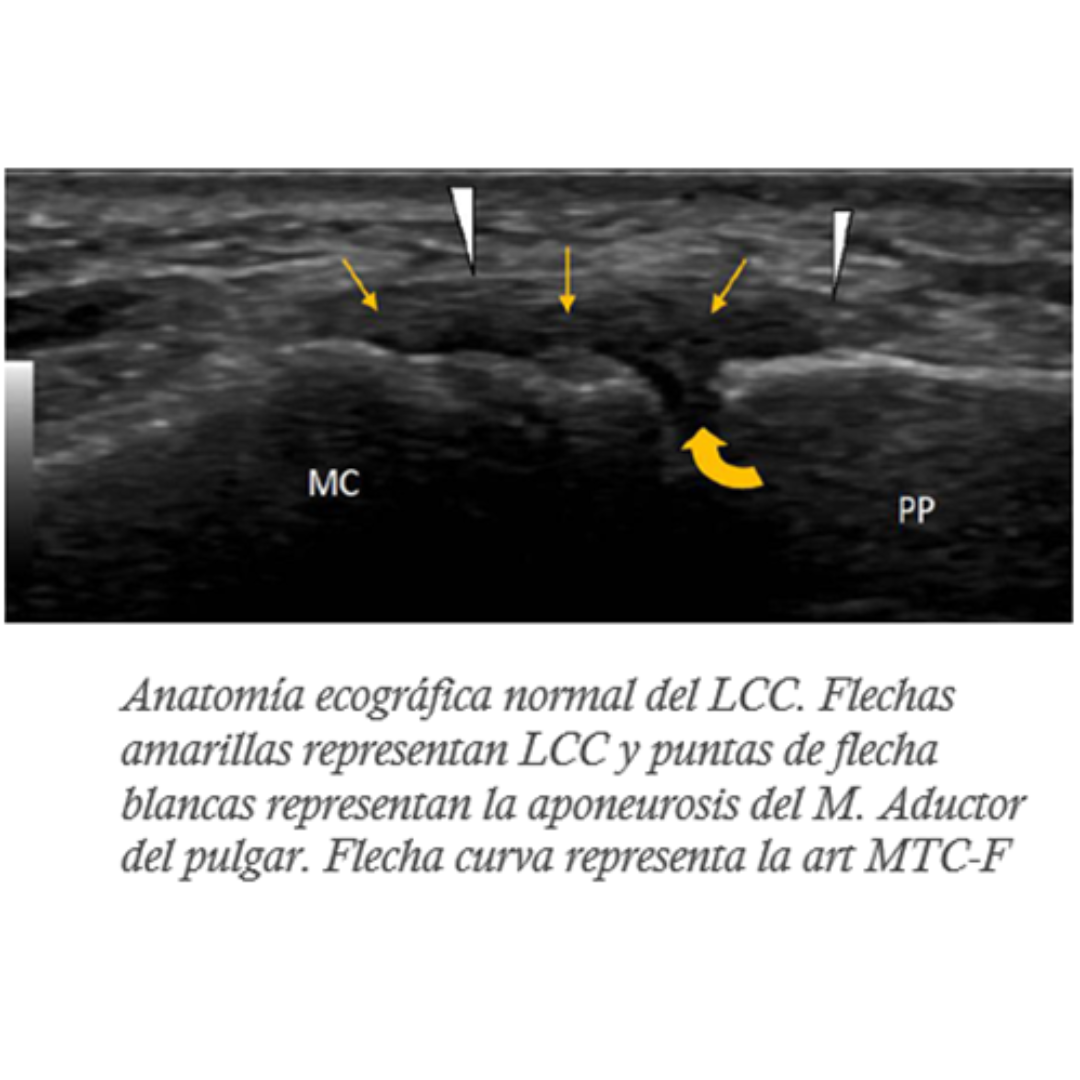
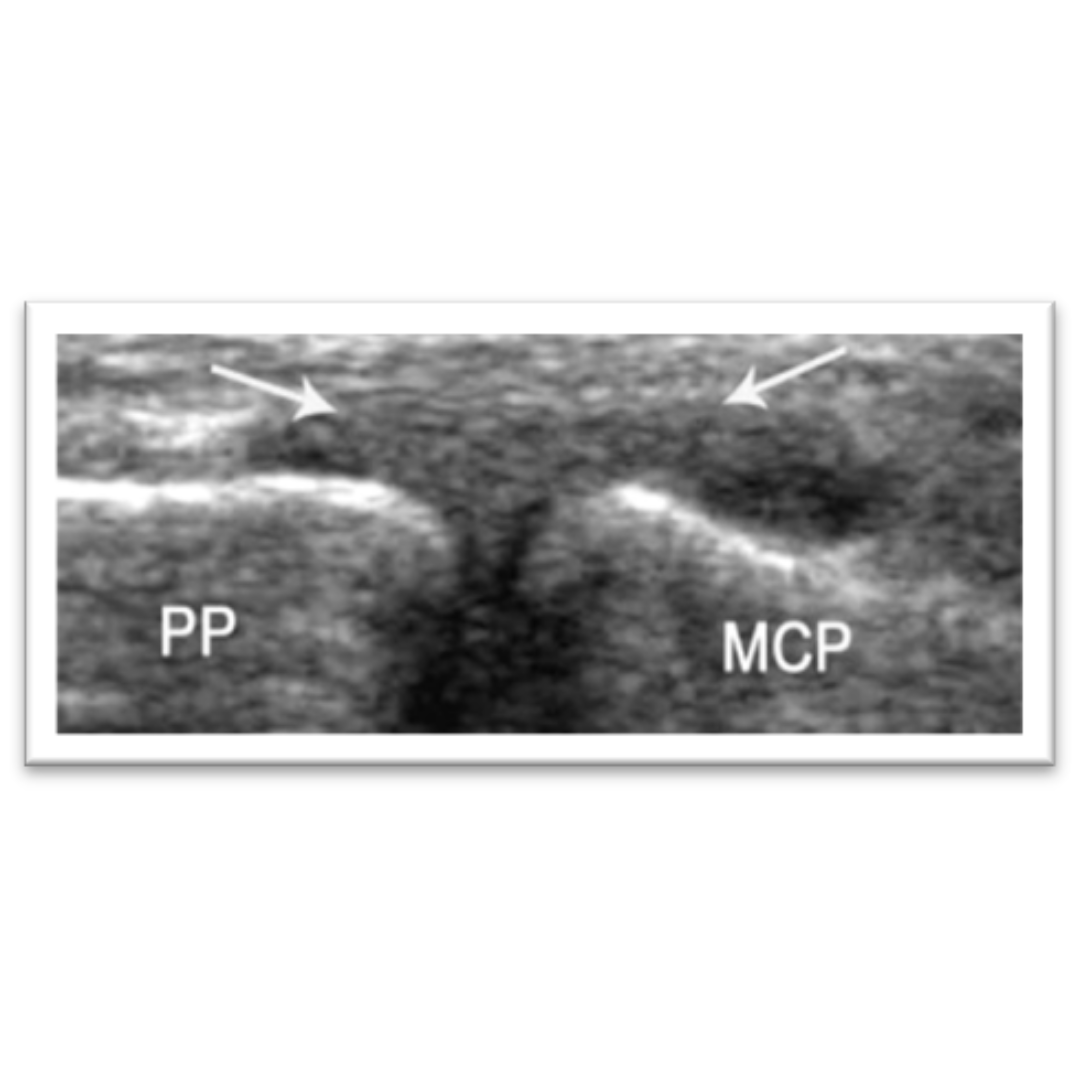
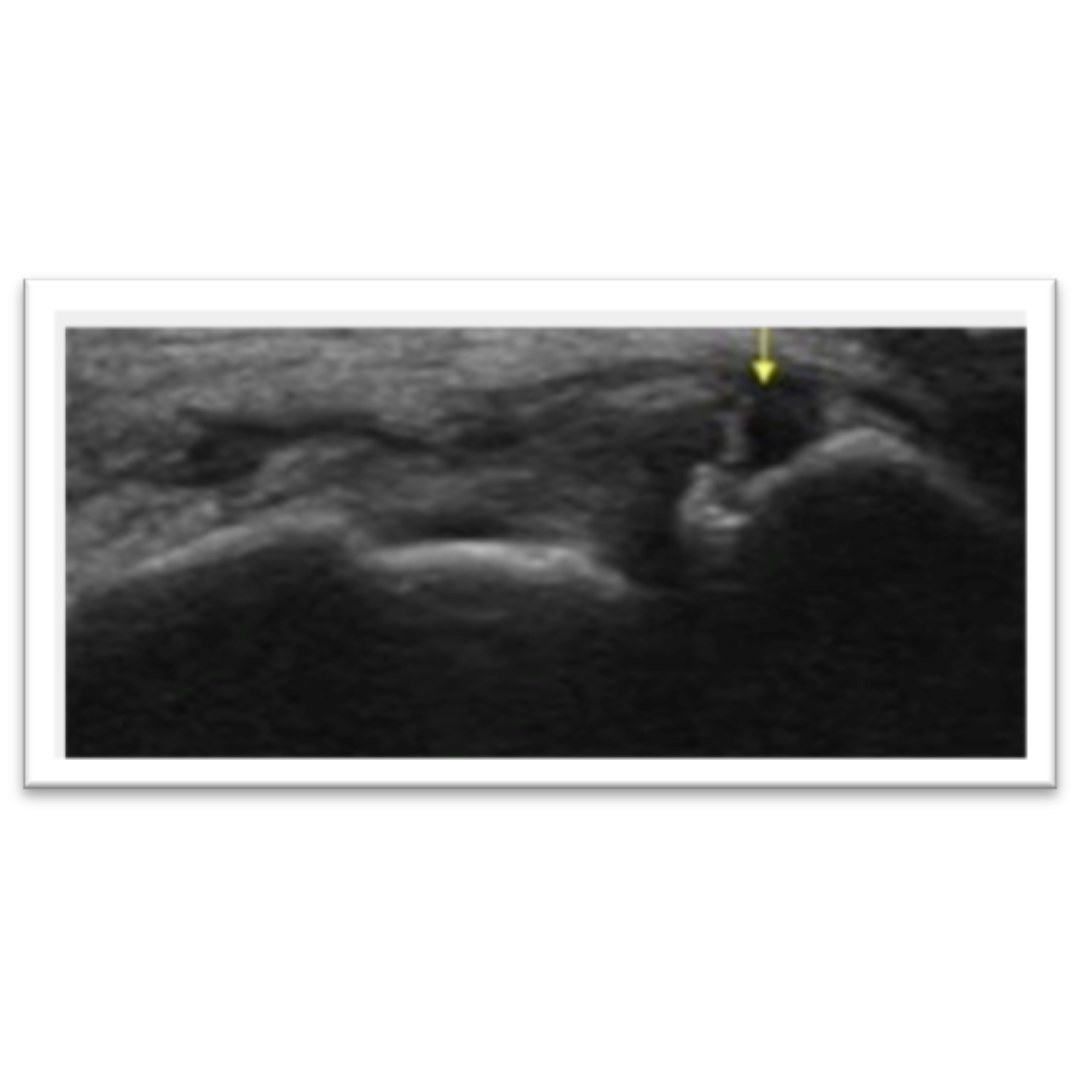
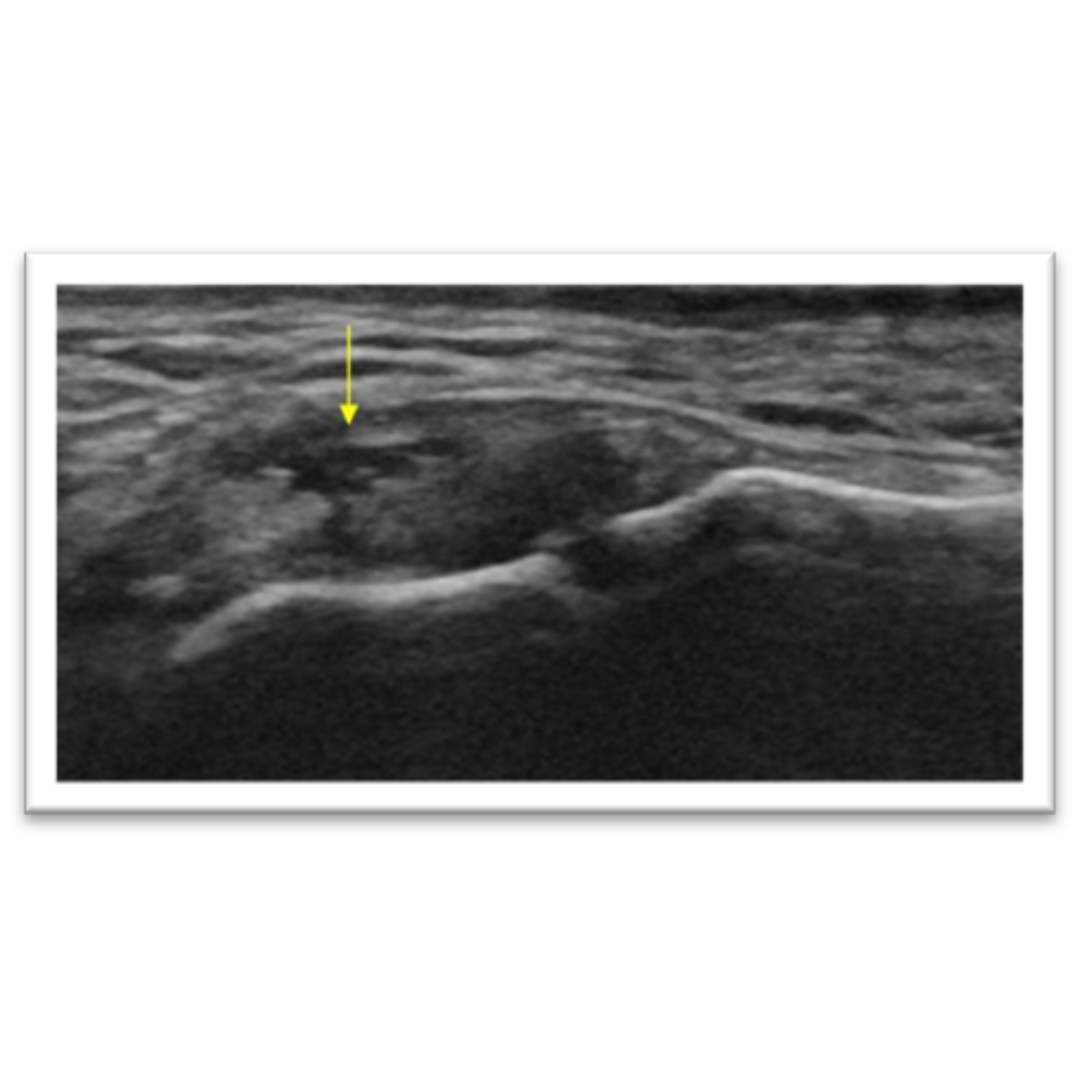
Hallazgos ecográficos esperables posterior a una tiroidectomía total por carcinoma tiroideo
TM Elizabeth Vidal Mansilla
Objetivo
La incidencia del Carcinoma Papilar (CAP) ha ido en aumento en nuestro país y con ello las tiroidectomías. La Asociación Americana de Tiroides (ATA) recomienda el seguimiento de pacientes tiroidectomizados con Ecografía y control de los niveles Tiroglobulina para pesquisar una recidiva.
Se realizó una revisión bibliográfica con el objetivo de conocer acabadamente los hallazgos ecográficos de un lecho tiroideo normal, el aspecto de los cambios post quirúrgicos tempranos, como aquellos de más larga data, algunas complicaciones post quirúrgicas y también revisaremos las características ecográficas de las lesiones sugerentes de una recidiva local, como una extensión ganglionar.
REVISIÓN ECOGRÁFICA
El tratamiento para pacientes con Carcinoma tiroideo es la tiroidectomía. Dependiendo del tratante y la extensión del carcinoma podemos encontrar pacientes con tiroidectomía total o parcial donde se extirpa un solo lóbulo, también dependerá de si existe extensión ganglionar, si se realizó un vaciamiento ganglionar y la magnitud de este. En algunos pacientes se extirpan paratiroides, sin embargo, la ATA sugiere evitar su extirpación.
El control con Ecografía posterior a tiroidectomía está recomendado por la ATA a los 6 y 12 meses, en conjunto con el chequeo de los niveles de Tiroglobulina. Un aumento en estos niveles podría hacer sospechar de recidiva, sin embargo, existen casos en los que se encuentra recidiva sin alteración de estos niveles.
Los controles muy precoces post tiroidectomía deben ser considerados para evaluar complicaciones post quirúrgicas, ya que el edema disminuye el rendimiento del examen para pesquisar recidiva.
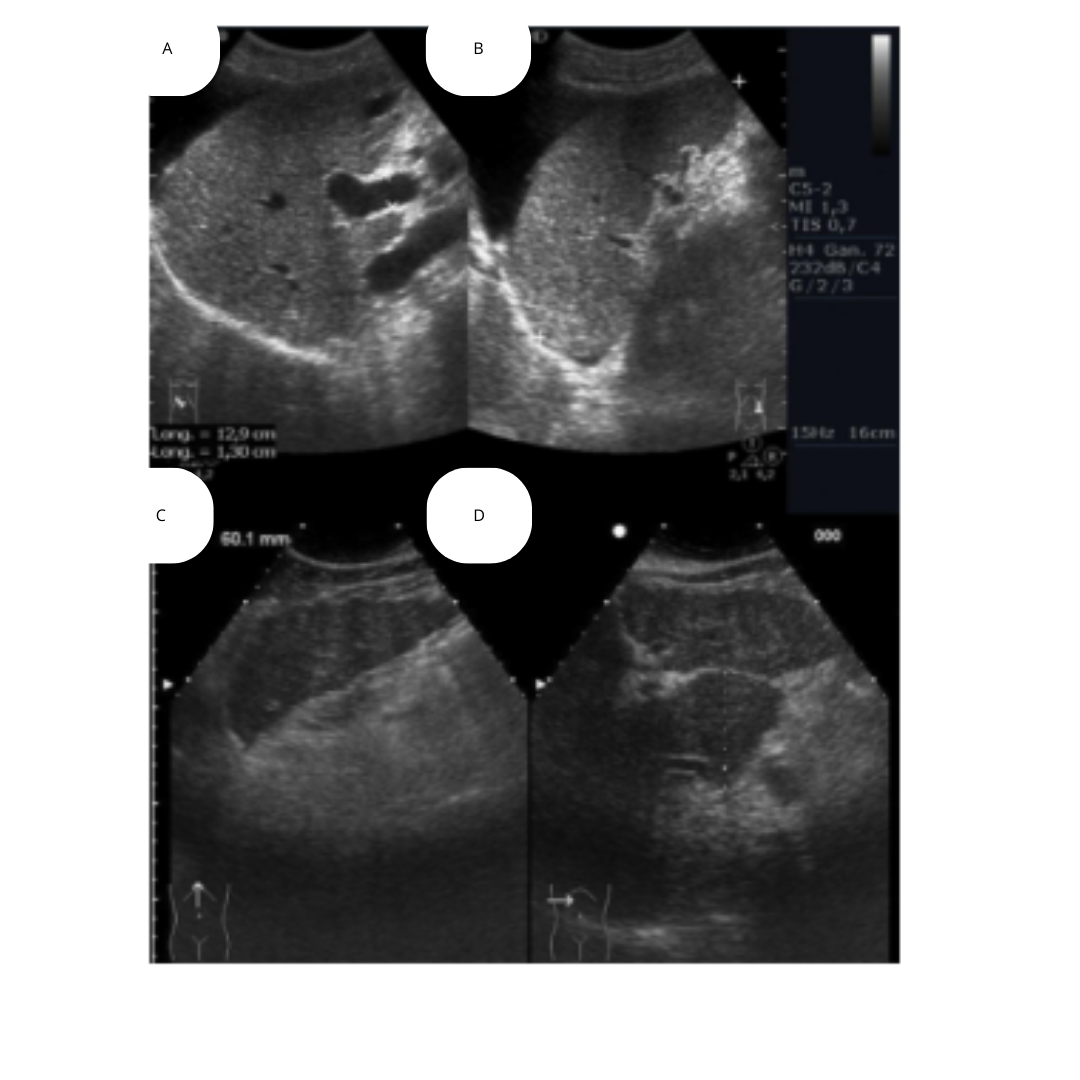
ASPECTO DEL LECHO TIROIDEO A 4 SEMANAS
Figura 1. Corte longitudinal del lecho tiroideo, cambios post quirúrgicos normales recientes en el lecho tiroideo donde se observa un aumento de ecogenicidad de hipodermis, engrosamiento dérmico, cambios a nivel profundo con dificultad para observar planos debido al edema.
ASPECTO DEL LECHO TIROIDEO A 12 SEMANAS
Figura 2. En un lecho tiroideo a los 12 meses post tiroidectomía, es esperable encontrar tejido fibroadiposo hiperecogénico ocupando el lecho glandular, que debe ser evaluado en cortes transversales y longitudinales. No debe
ser confundido con remanente glandular tiroideo.
HALLAZGOS ECOGRÁFICOS TEMPRANOS POST TIROIDECTOMÍA
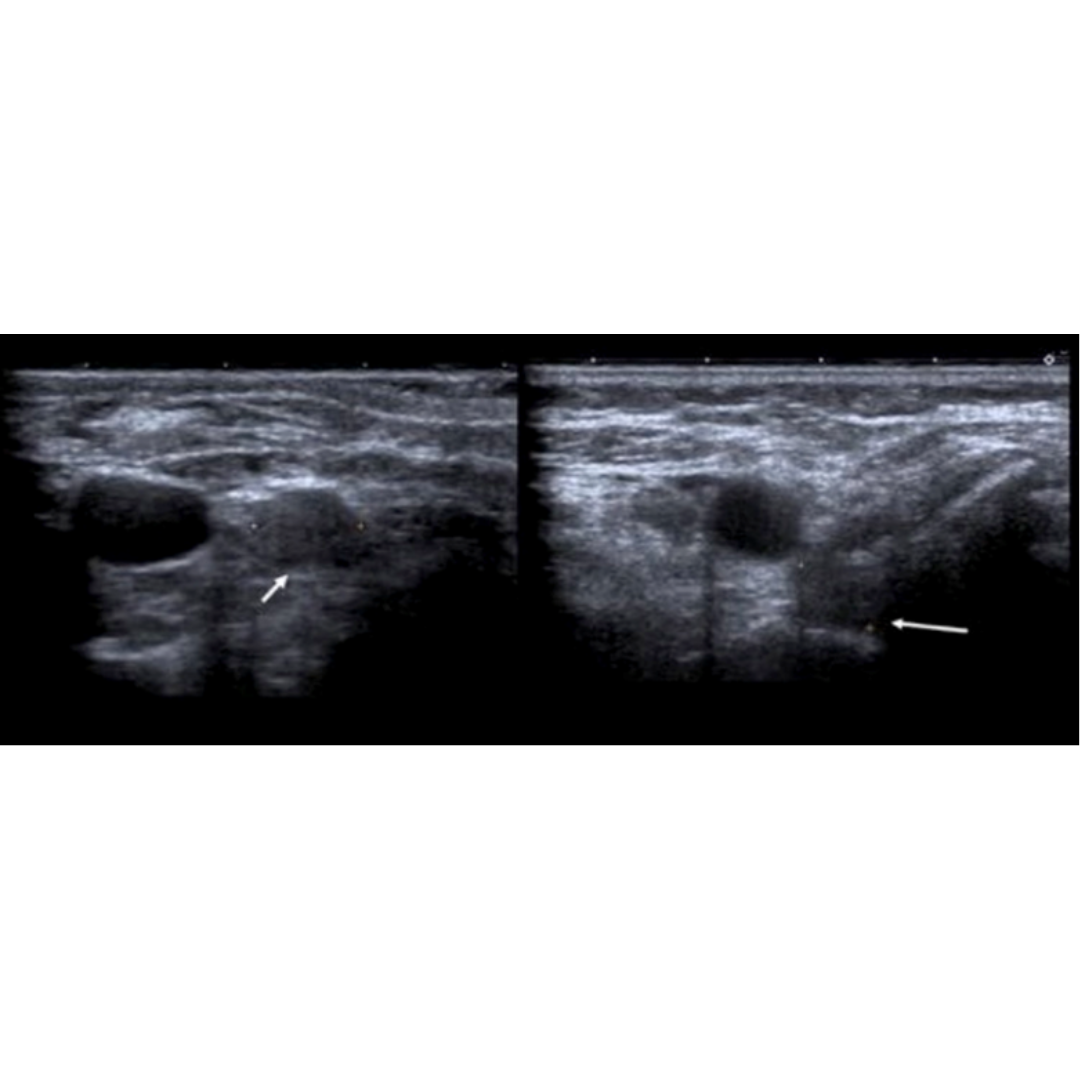
Linfoceles
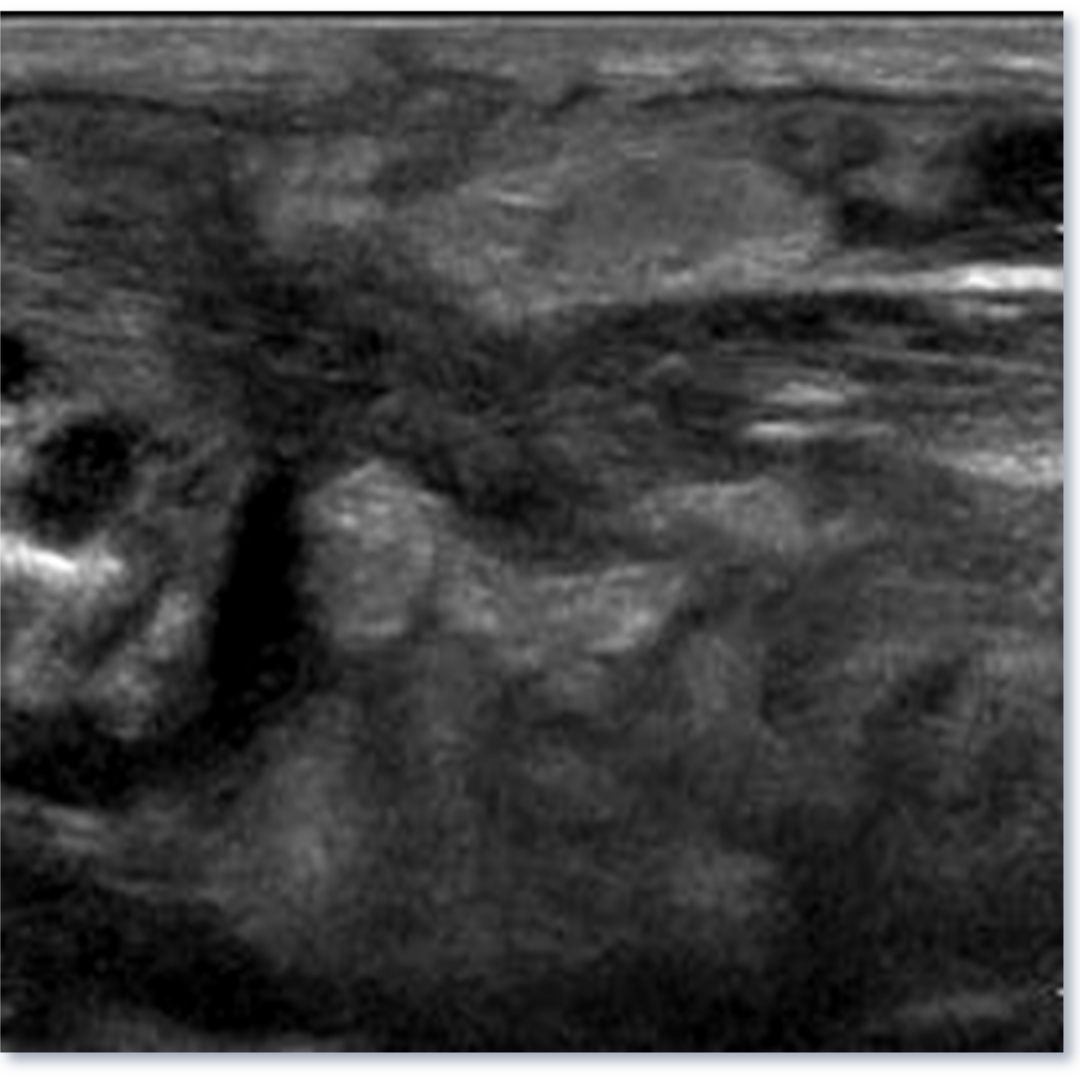
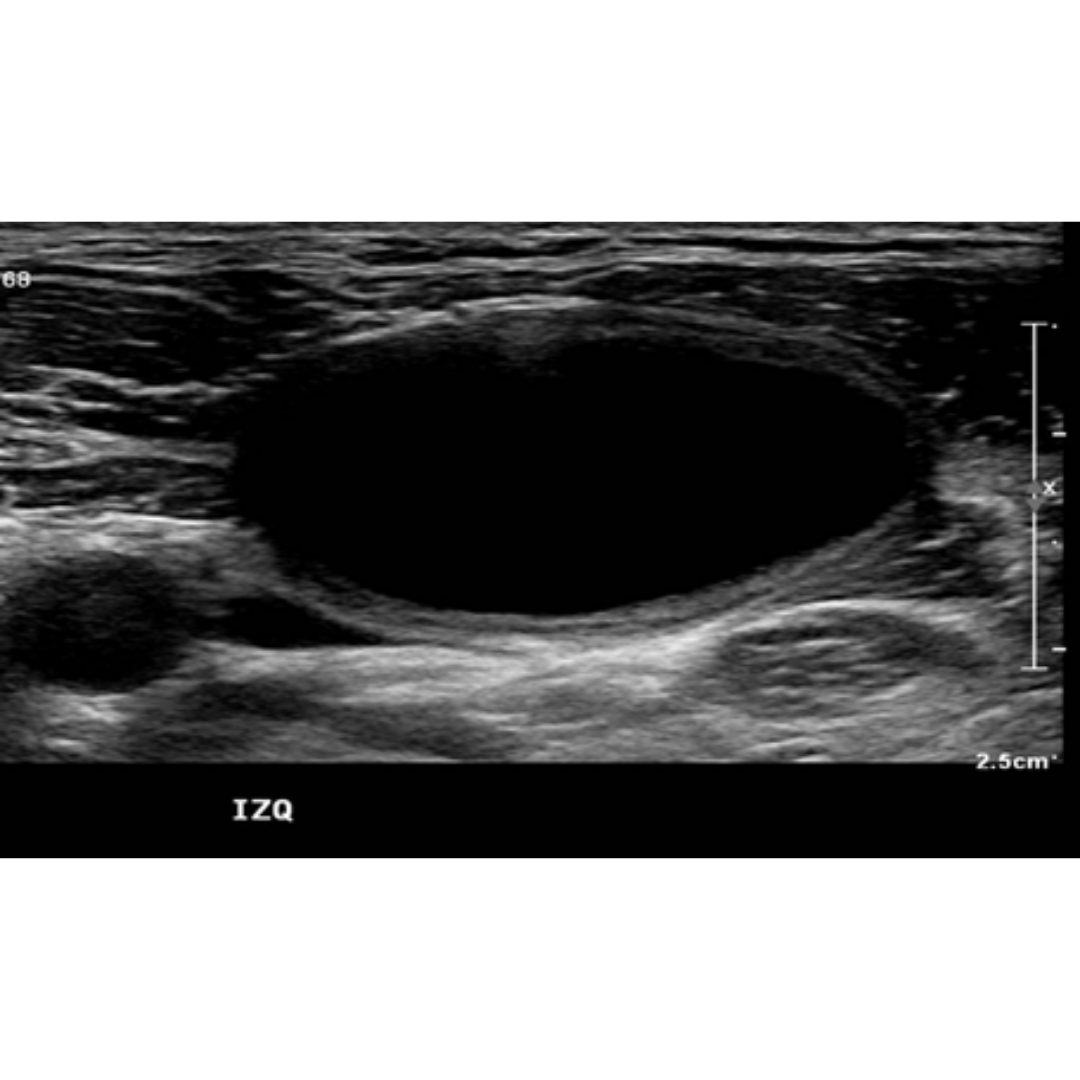
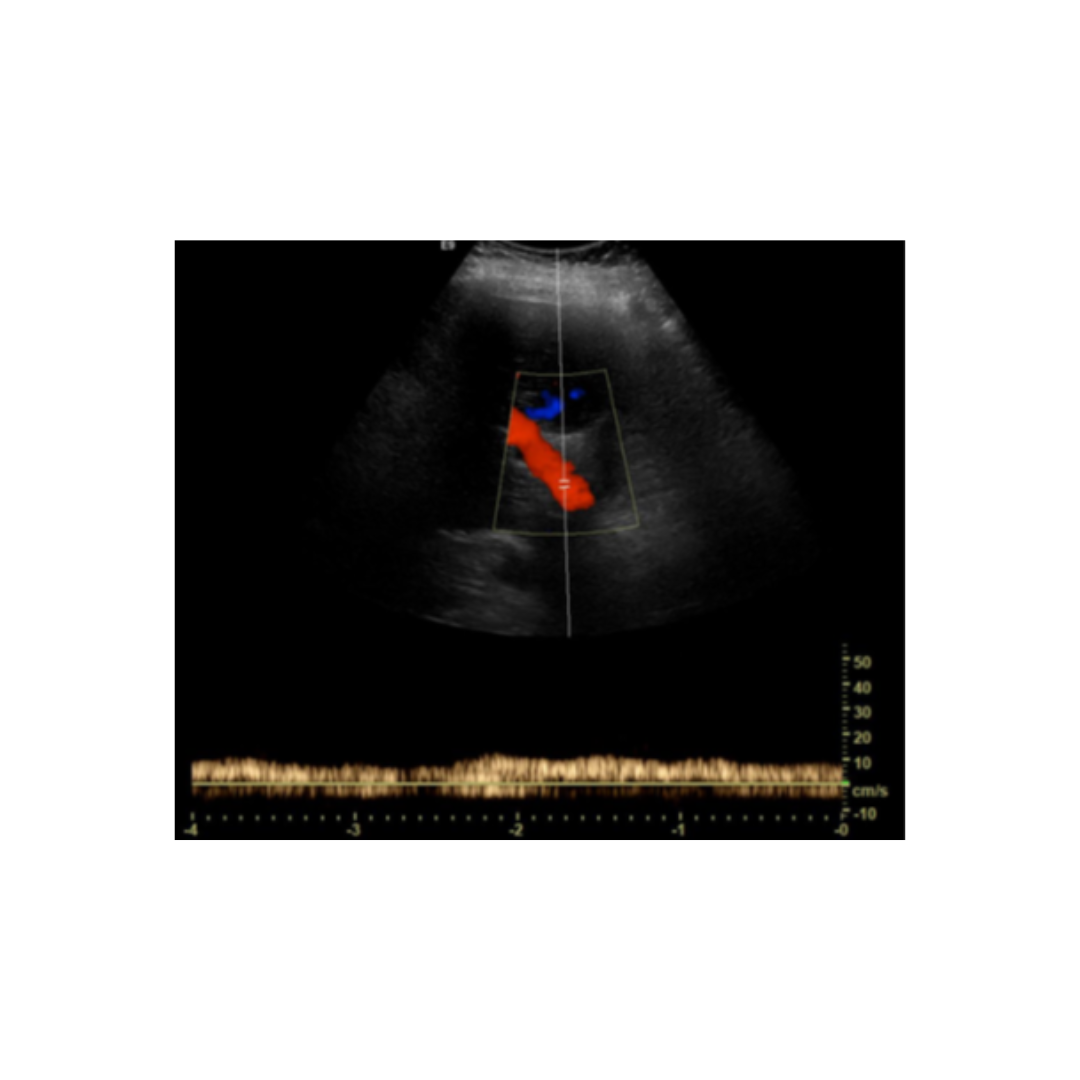
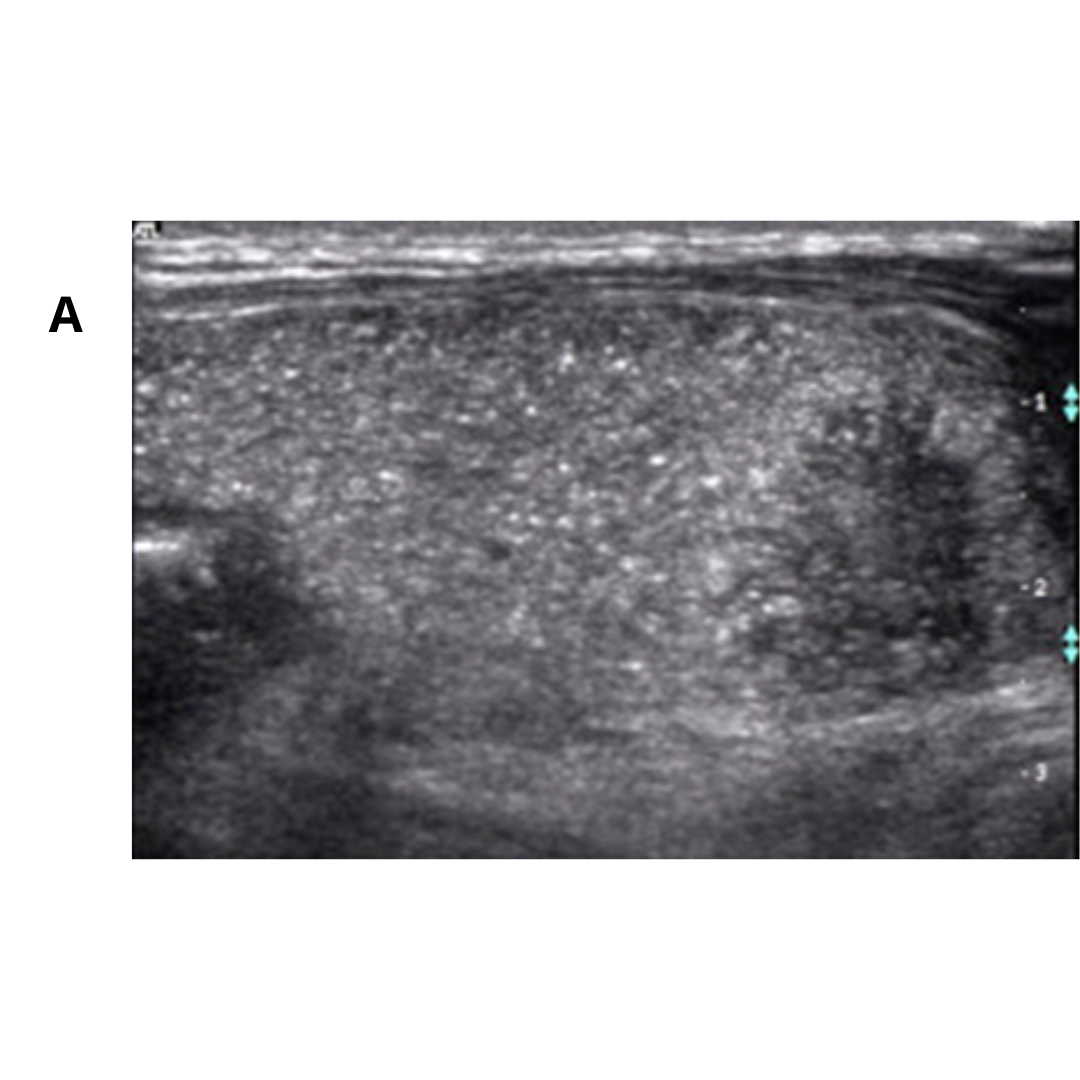
Las linfoceles son acumulaciones quísticas linfáticas subcutáneas revestidas por un saco endotelial. Pueden surgir como una complicación por la disección de linfonodos cervicales, asociado a la tiroidectomía. Esta lesión puede tener una incidencia de 1-6%. Suelen controlarse bajo Ecografía hasta su completa desaparición espontánea.
Hallazgos ecográficos:
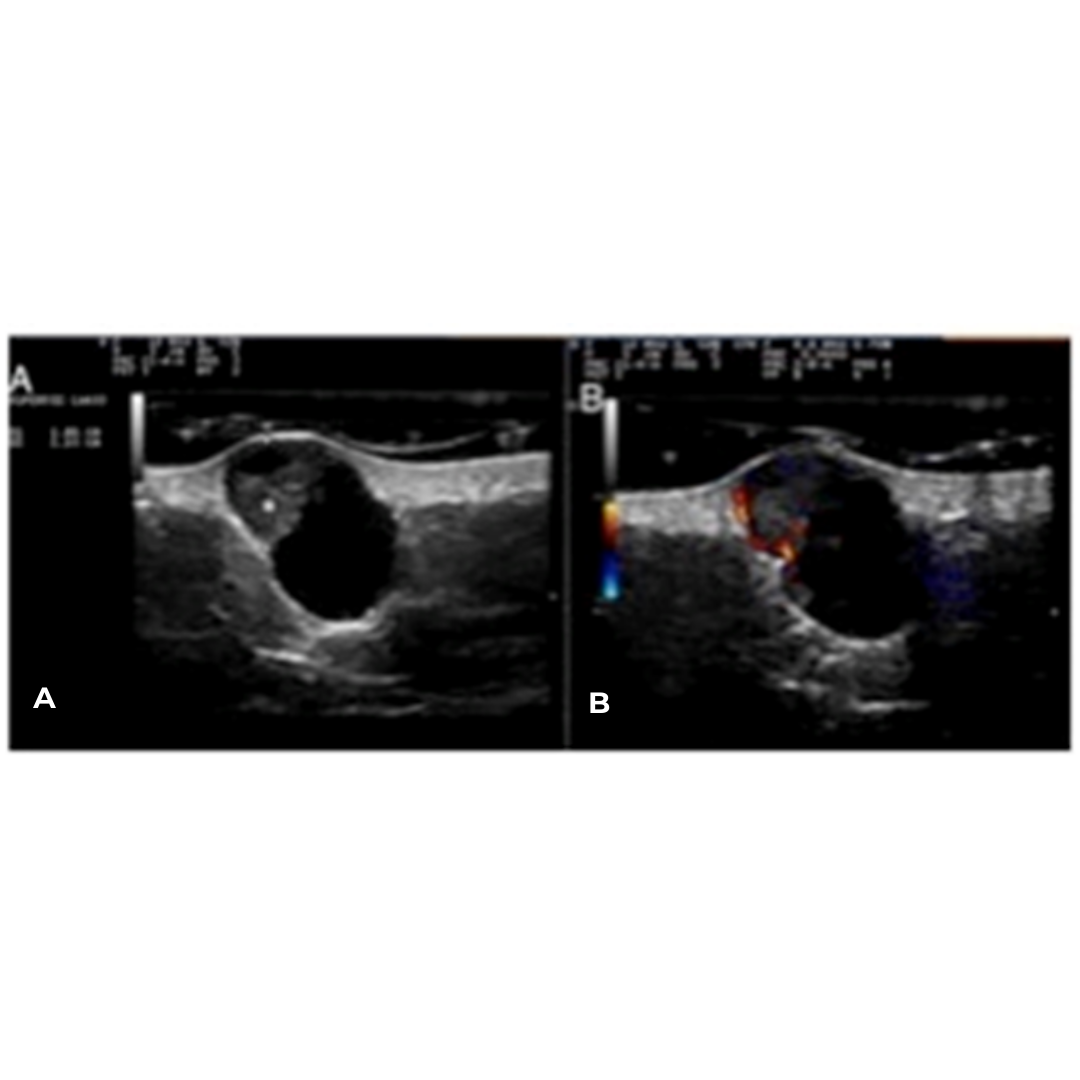
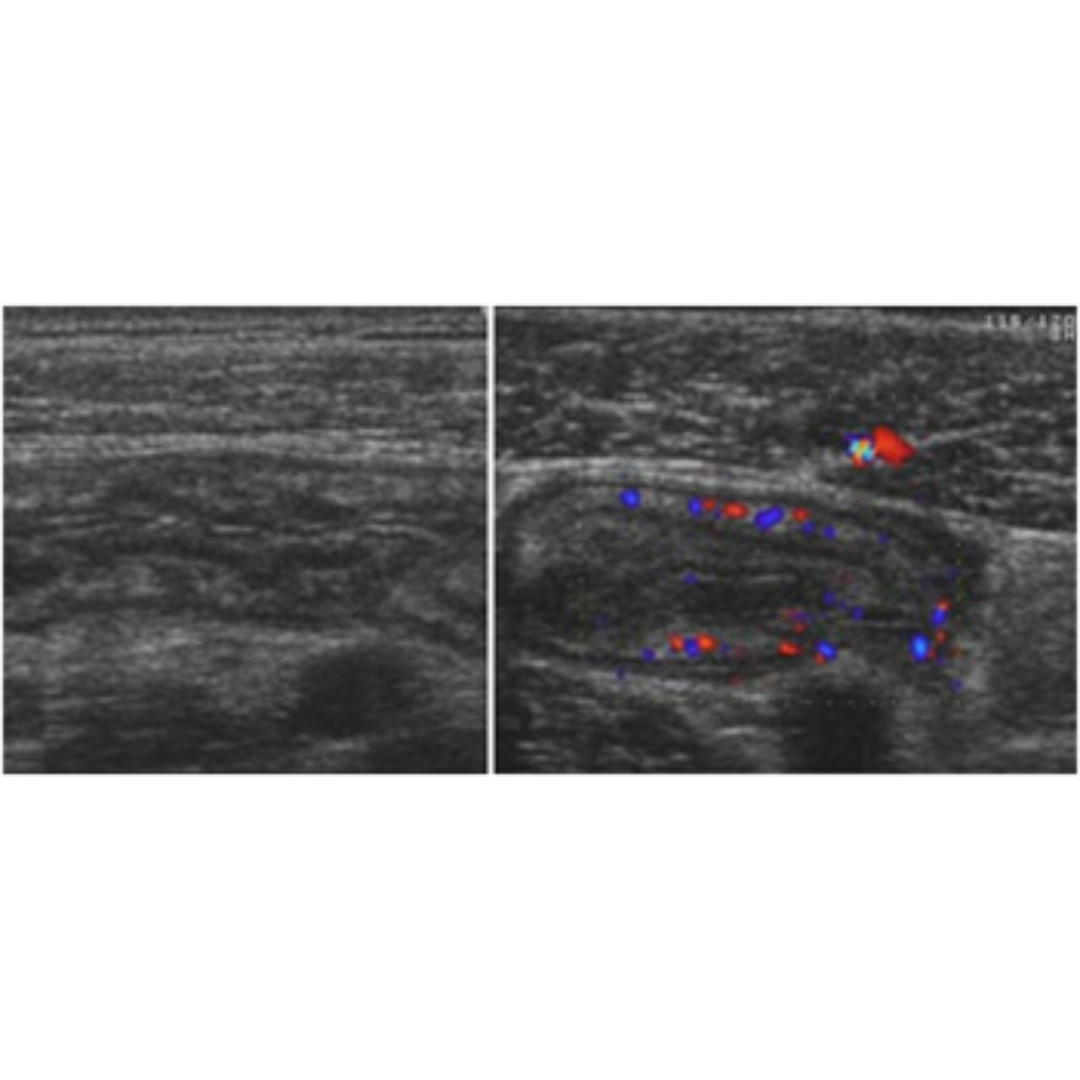
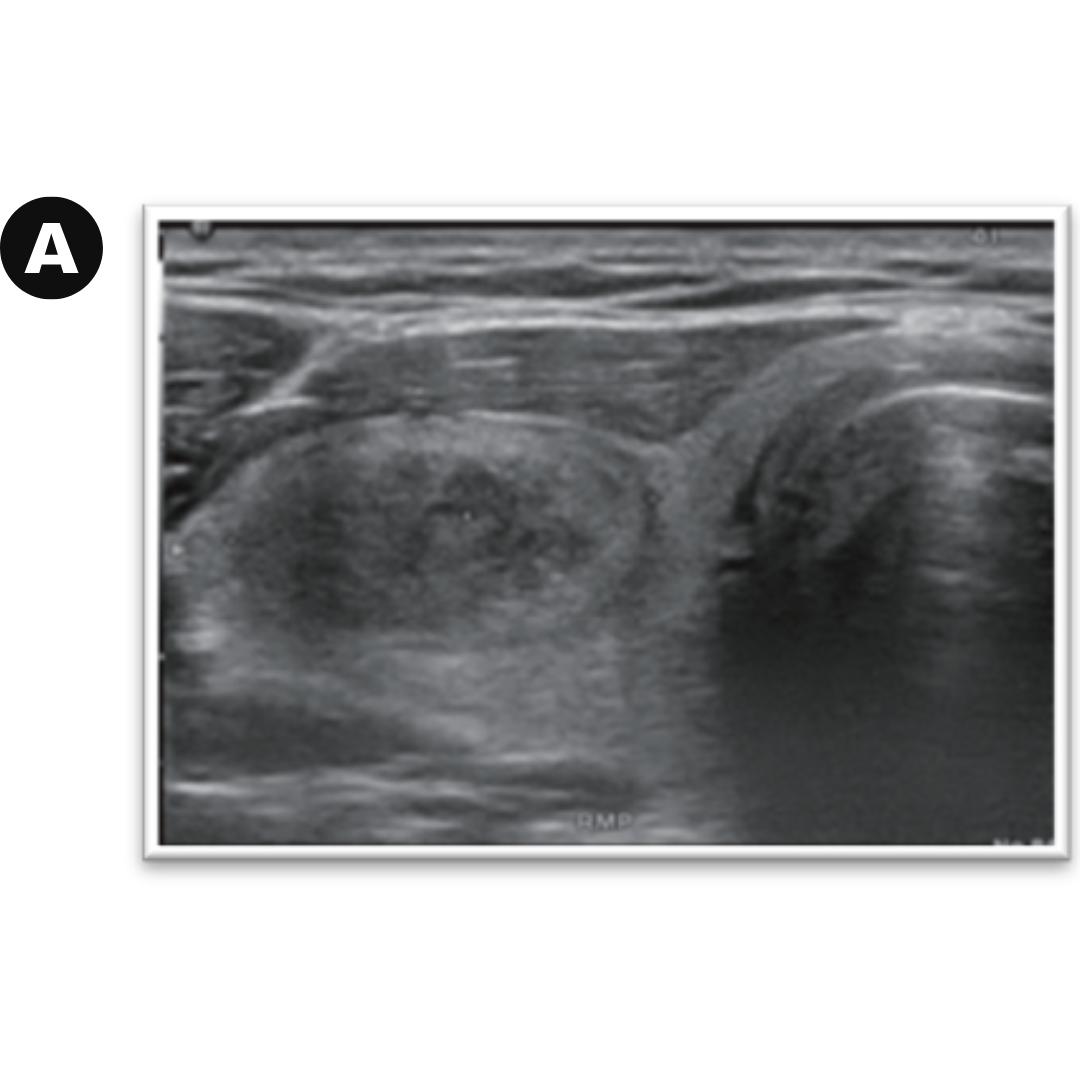
Se observa colección anecogénica, sin vascularización al Doppler, bien delimitada, con cápsula periférica, habitualmente ubicado entre segmentos cervicales III y IV.
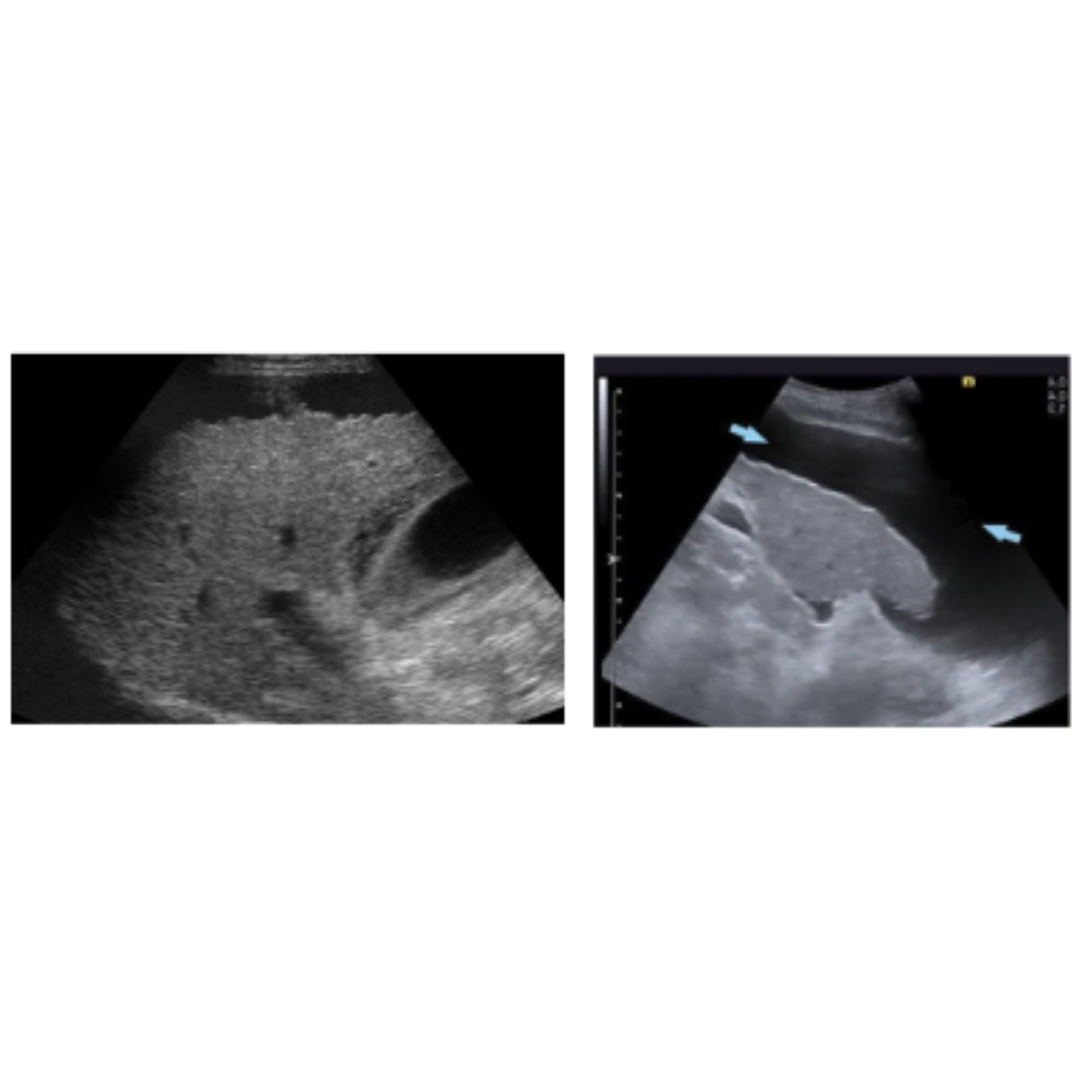
Figura 3. Linfocele en compartimento cervical izquierdo.
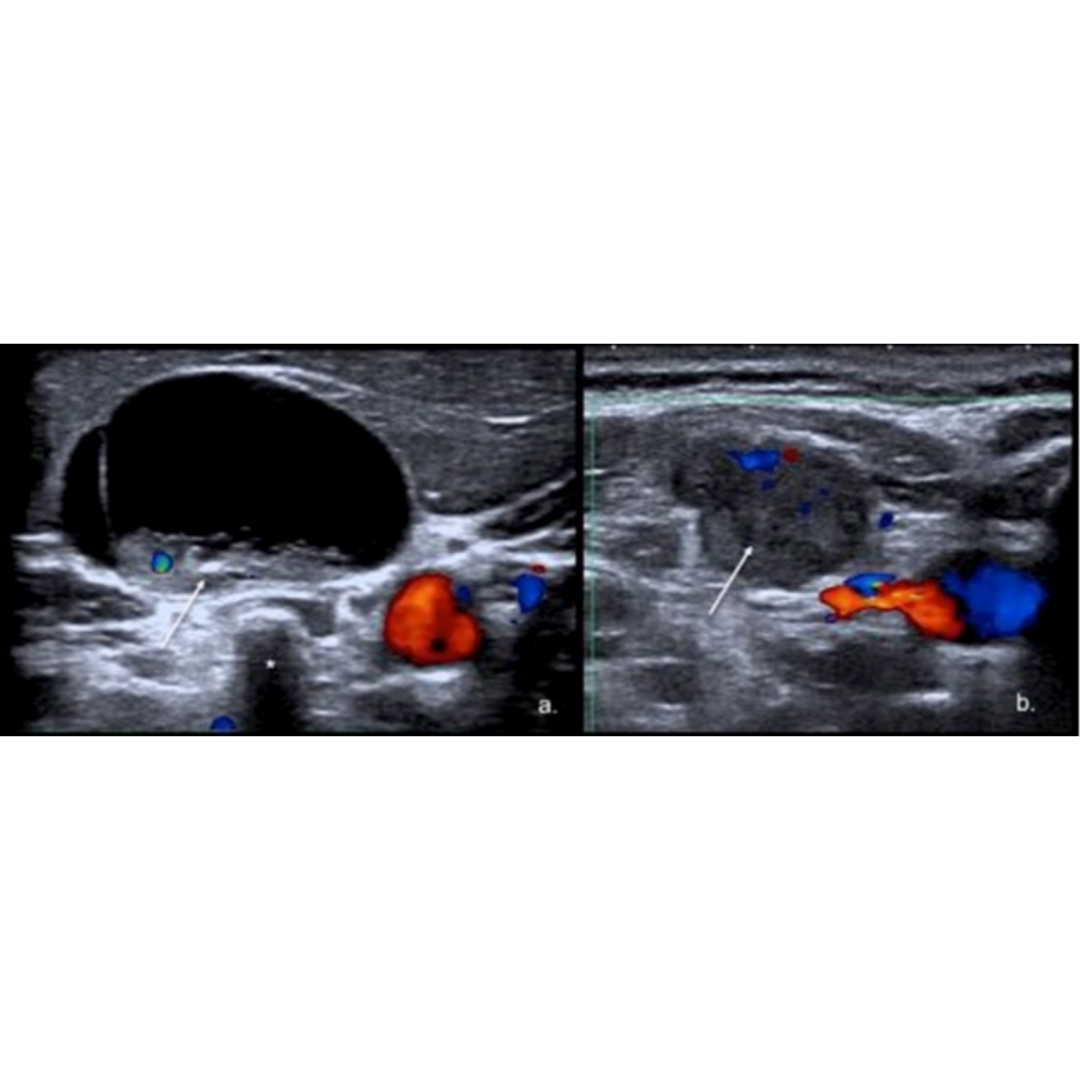
Hematoma
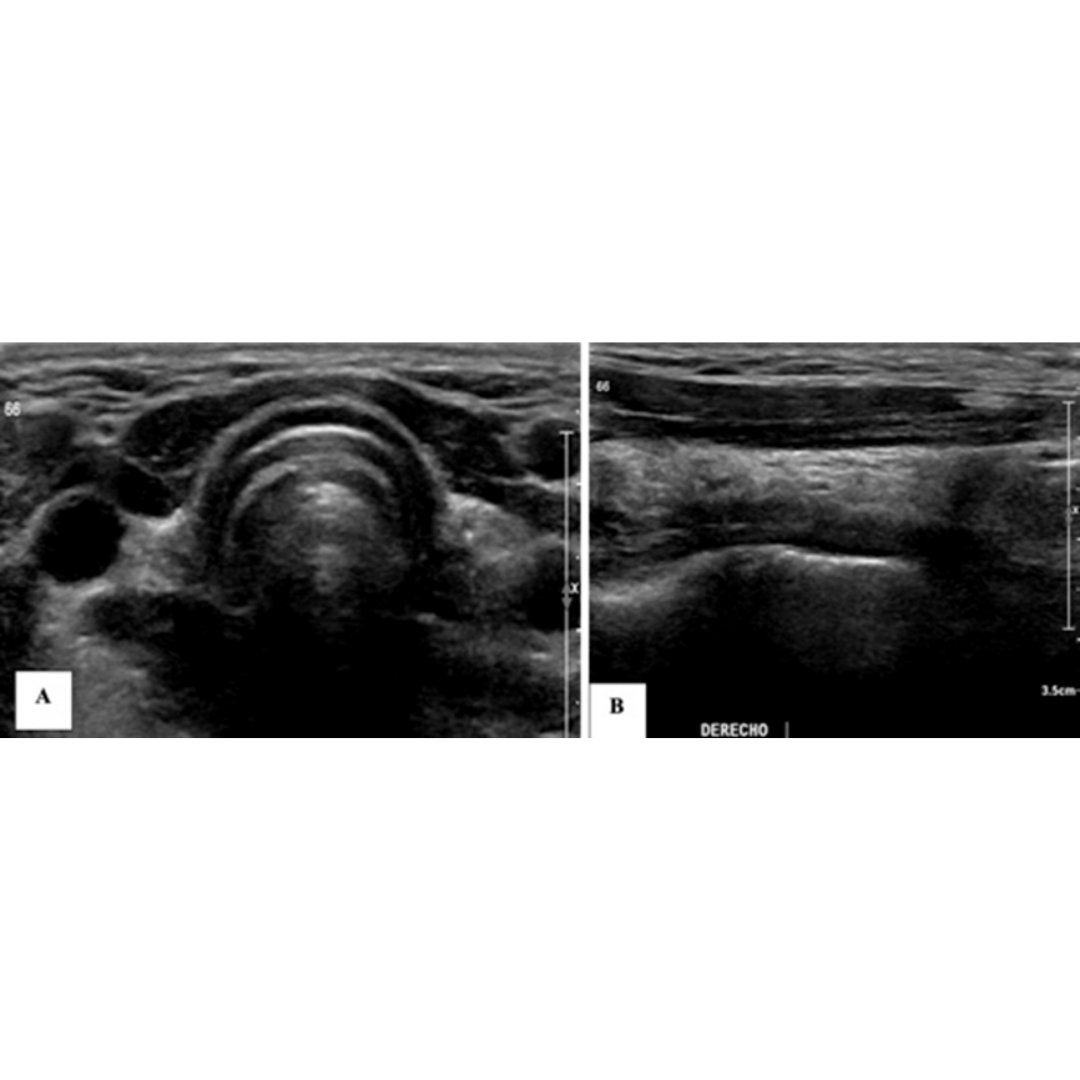
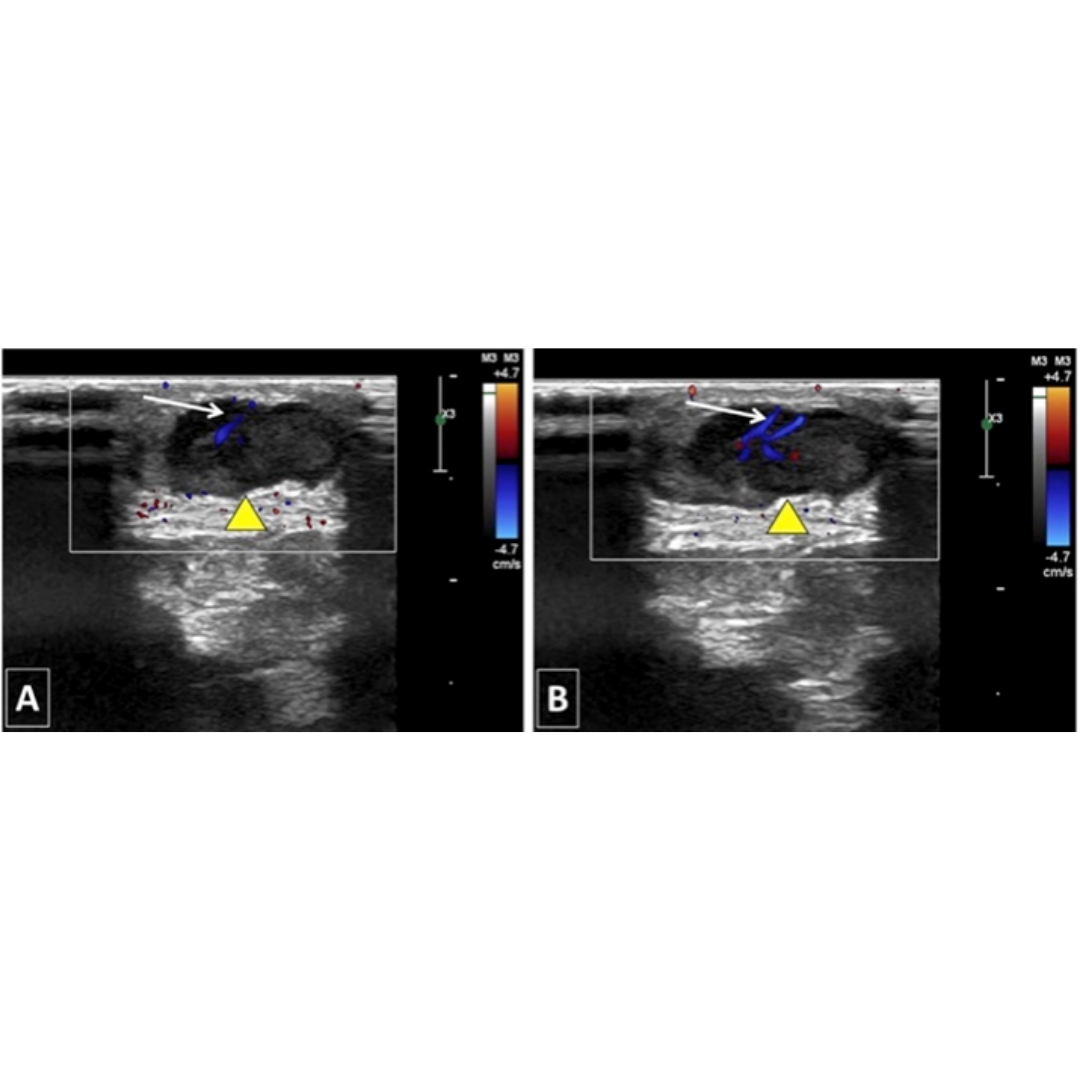
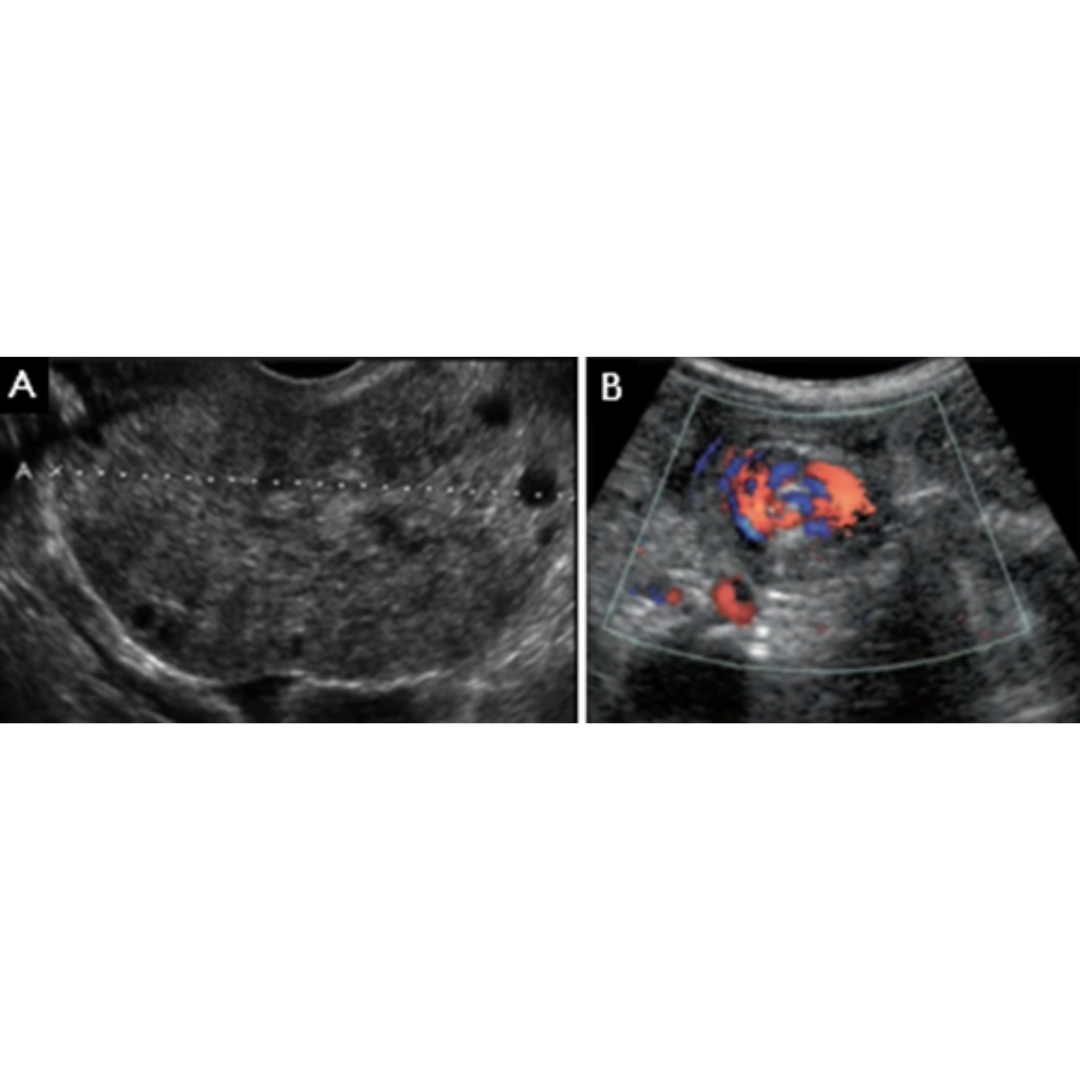
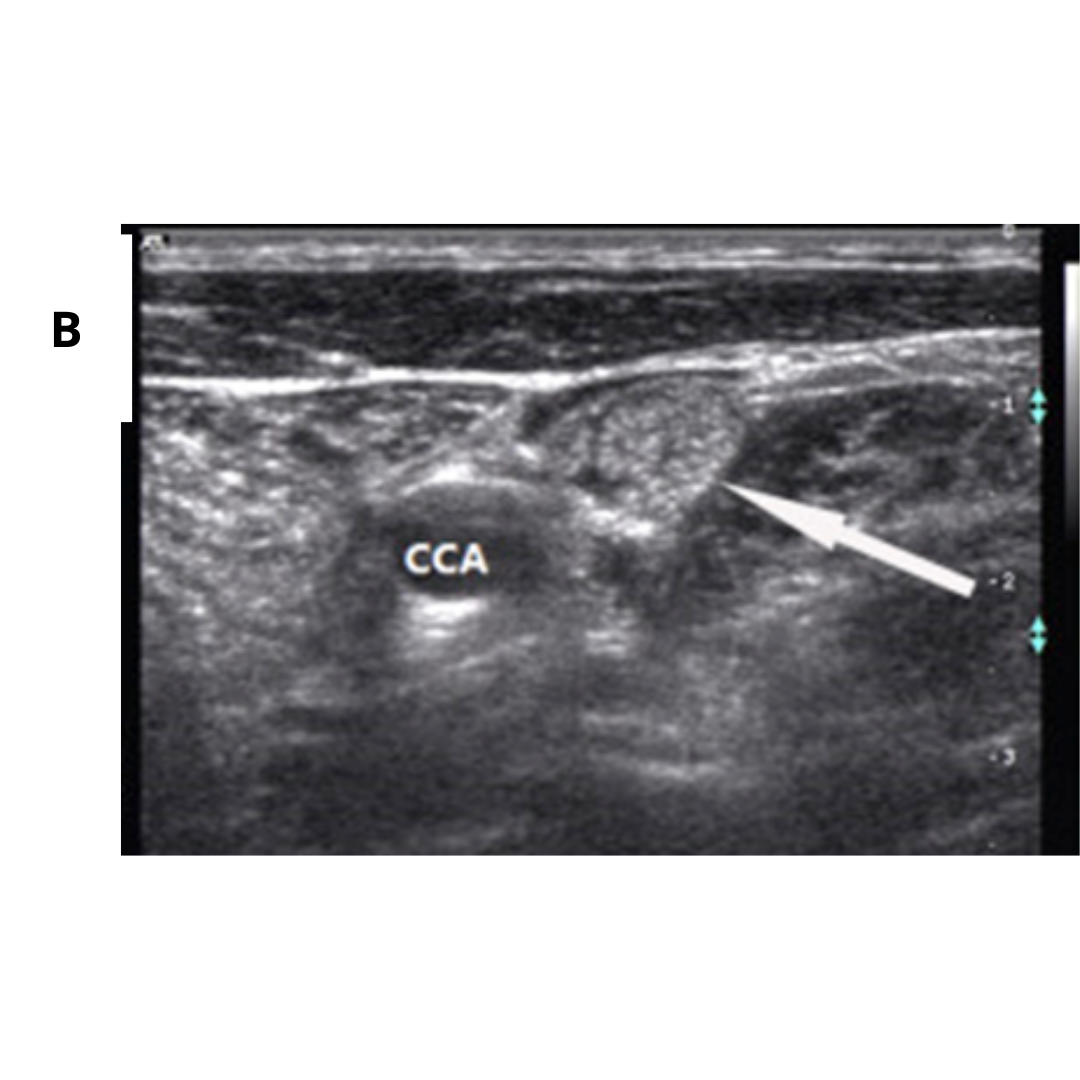
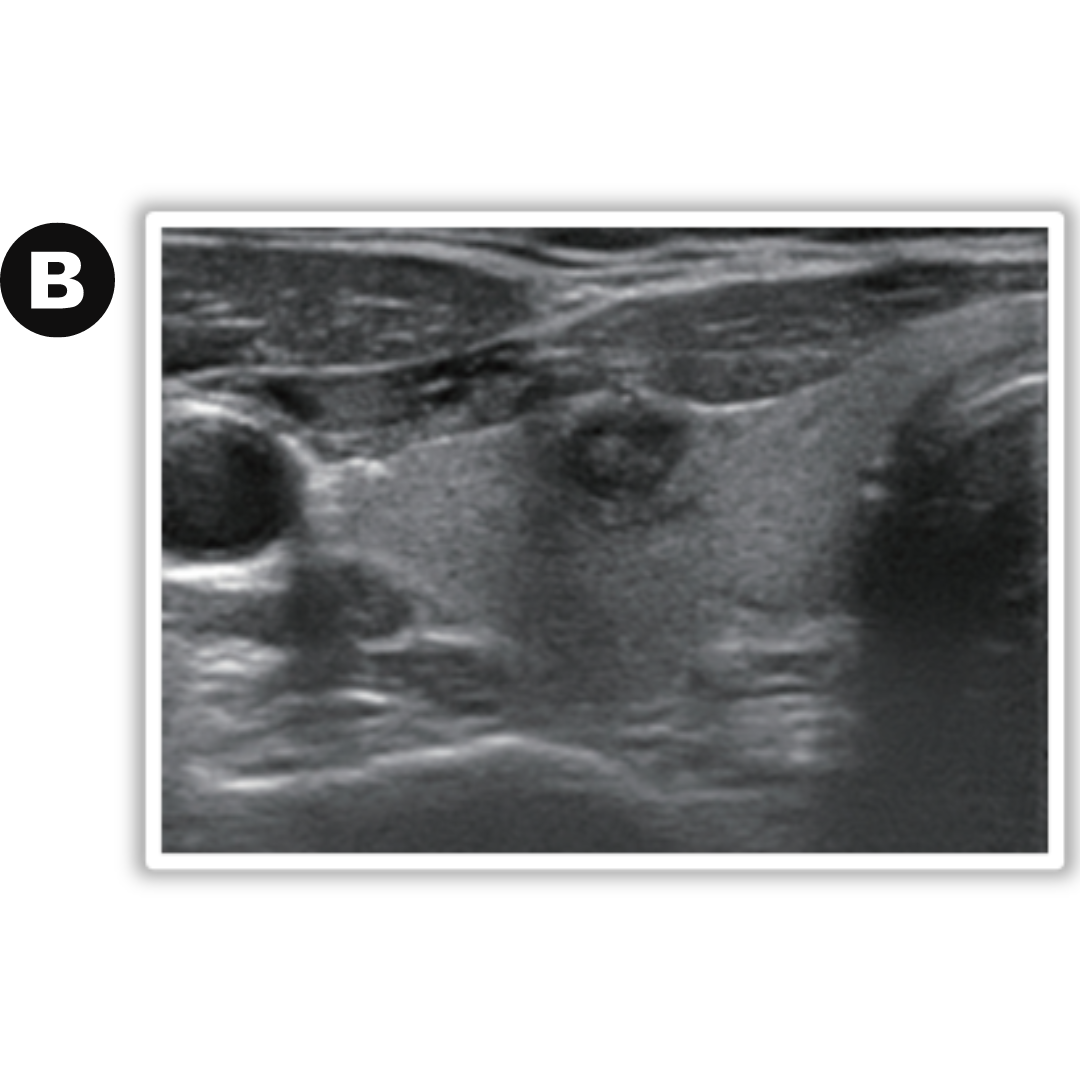
Habitualmente el hematoma postquirúrgico (figura 4) se observa cuando ha existido además de la tiroidectomía, una linfadenectomía en el contexto de un carcinoma de tiroides con metástasis ganglionar. Es un hallazgo que se podría encontrar las primeras semanas posterior a la cirugía.
Hallazgos ecográficos:
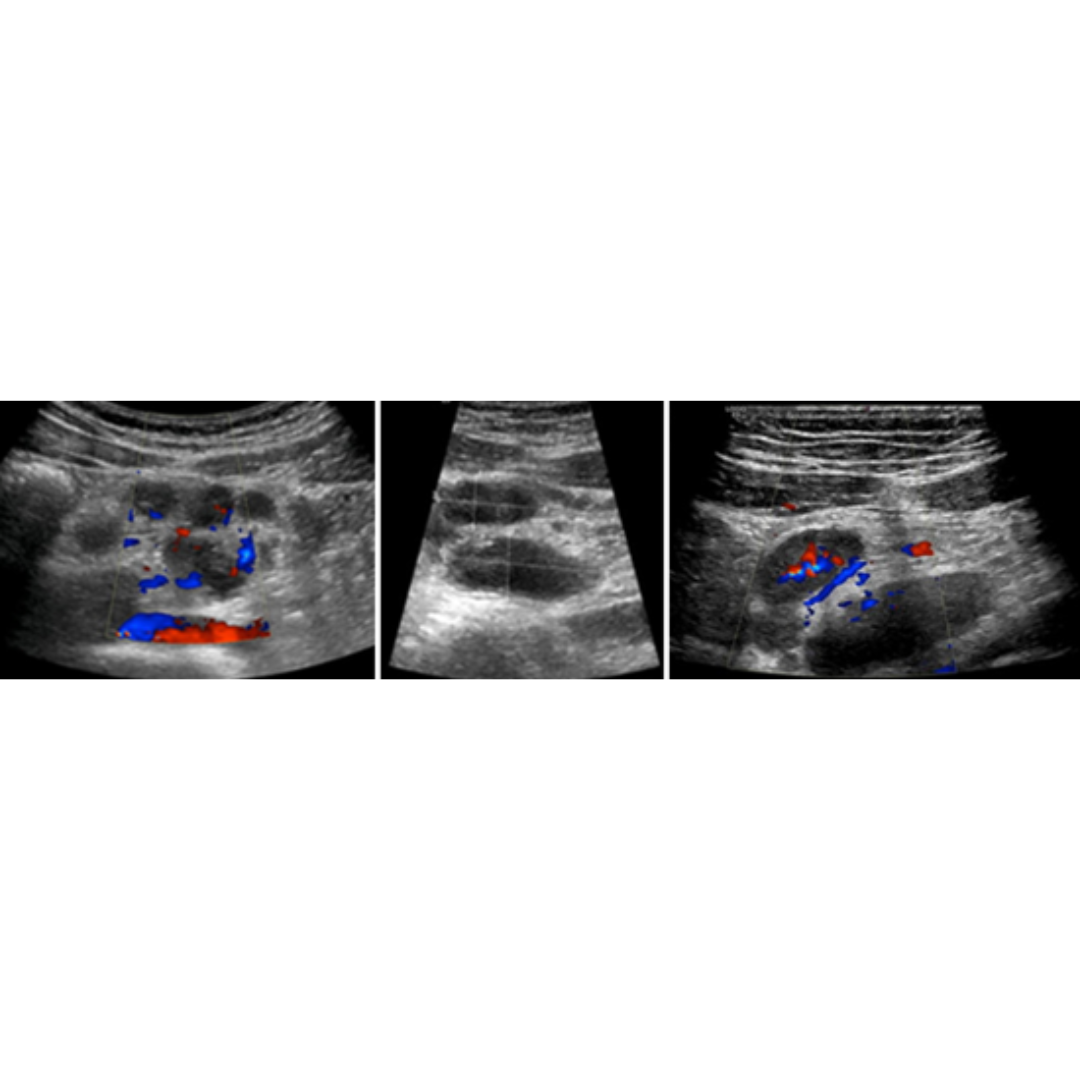
Colección con contenido hipoecogénico, de ecogenicidad variable dependiendo el tiempo desde la cirugía será la ecogenicidad, sin vascularización al Doppler color.
Figura 4. Hematoma post quirúrgico, por linfadenectomía izquierda, imagen (a) se observa corte longitudinal y en imagen (b) corte transversal a nivel del segmento cervical III.
Presencia de agentes hemostáticos en lecho tiroideo
En algunas tiroidectomías los cirujanos optan por usar agentes hemostáticos como Gelfoam (marca Pfizer), Gelita Hemospon o Surgispon, un material de esponja de gelatina indicado en procedimientos quirúrgicos como un auxiliar para la hemostasia, cuando el control del sangrado mediante procedimientos convencionales no es efectivo o resulta impracticable.
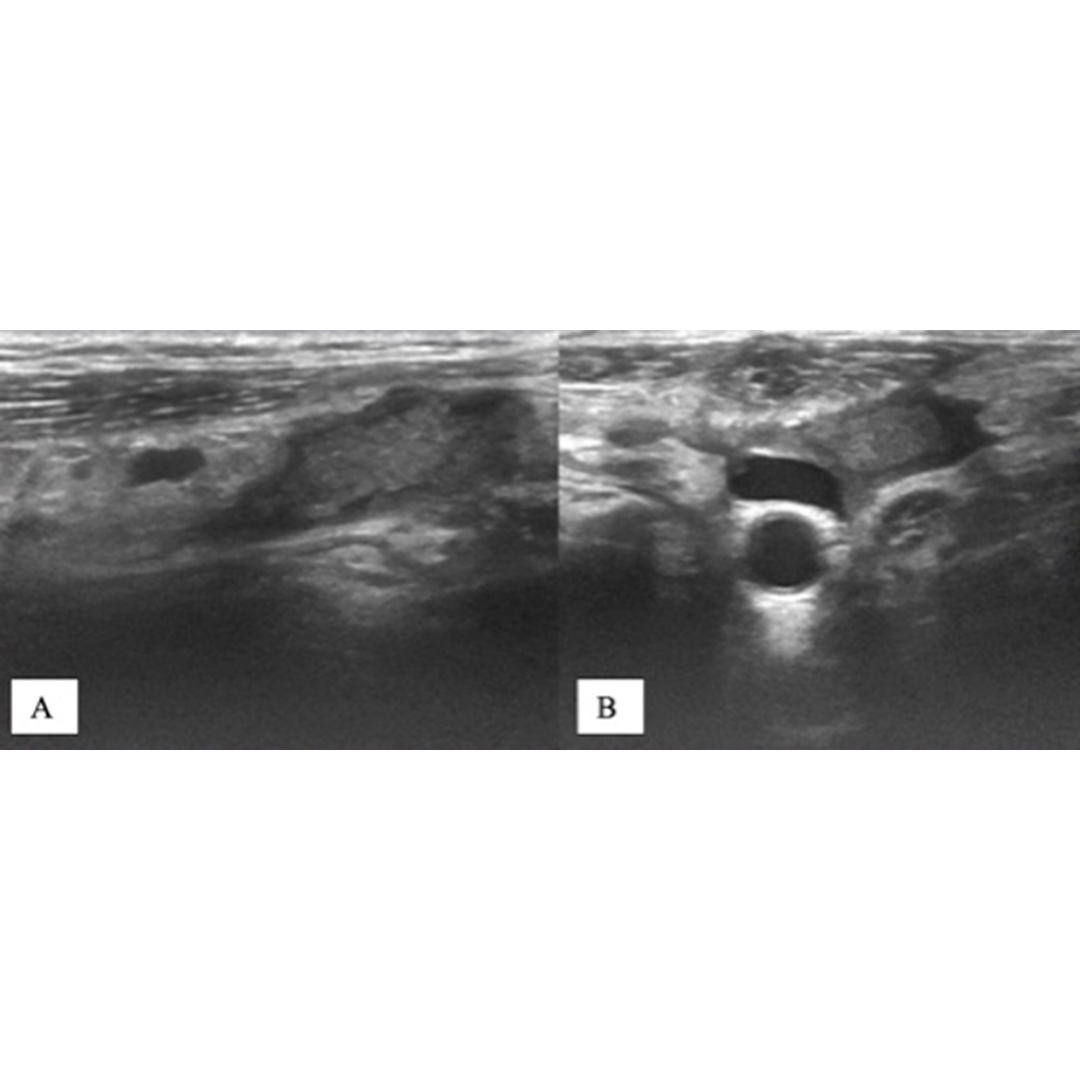
Un paciente que se realiza una ecografía dentro de las 6 semanas posteriores a la cirugía y luego de haber recibido esta esponja gelatinosa probablemente aún no se encuentre absorbida en su totalidad, y la observemos bajo Ecografía como una imagen hiperecogénica generando muchas veces imágenes similares a un remanente de tejido tiroideo, similares a un absceso o bien simular una recidiva local.
Conocer la historia clínica del paciente y la data de la cirugía son relevantes para diferenciarlos.
Hallazgos ecográficos esperables para diferenciar una esponja gelatinosa hemostática de un remanente tiroideo:
Imagen hiperecogénica homogénea
No vasculariza al Doppler
No presenta ecoestructura de parénquima similar a la glándula tiroidea. En caso de dudas siempre podemos usar de referencia las glándulas submandibulares para comparar el parénquima.
Se presenta sólo dentro de las primeras 6 semanas posteriores a la cirugía, éste antecedente es fundamental para su existencia.
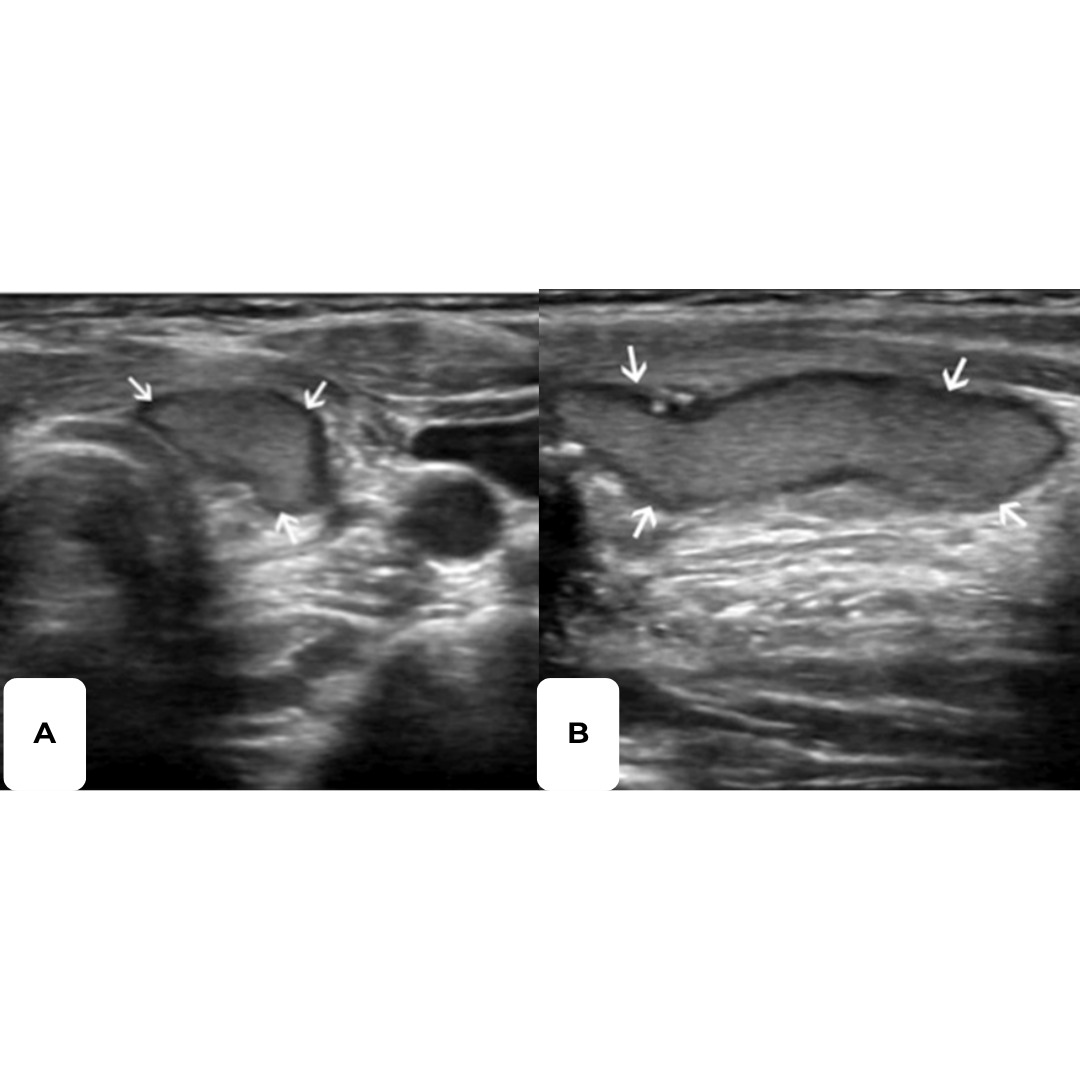
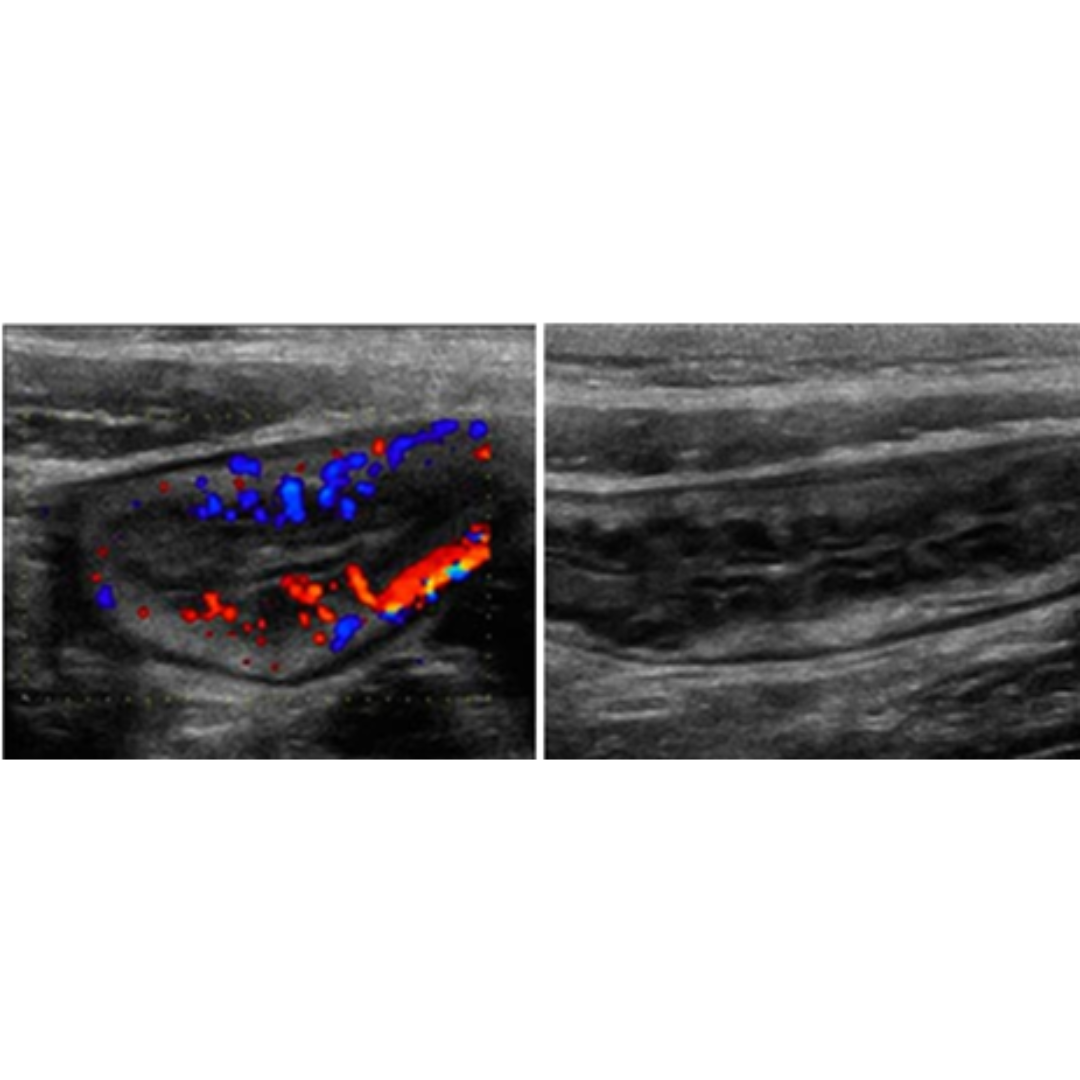
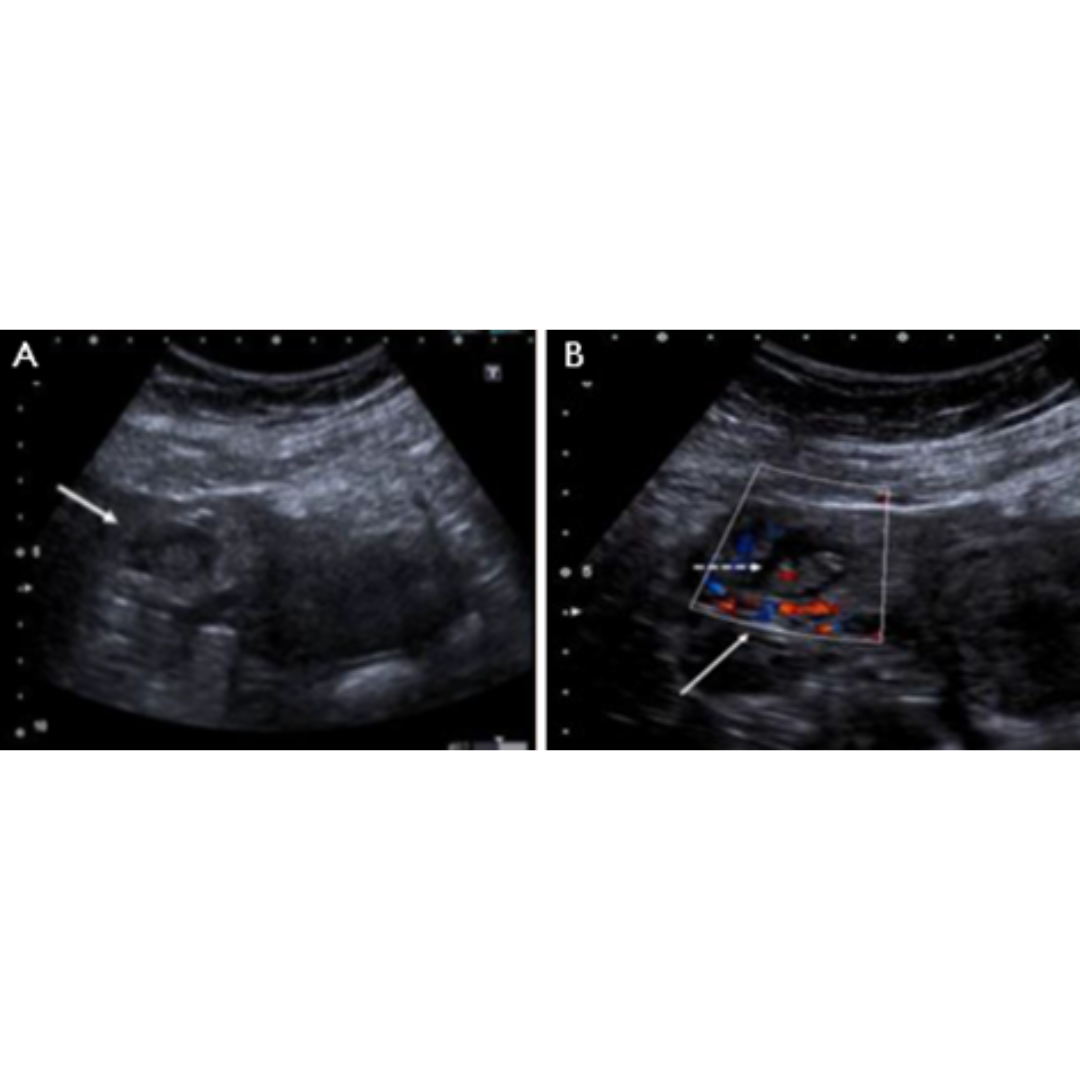
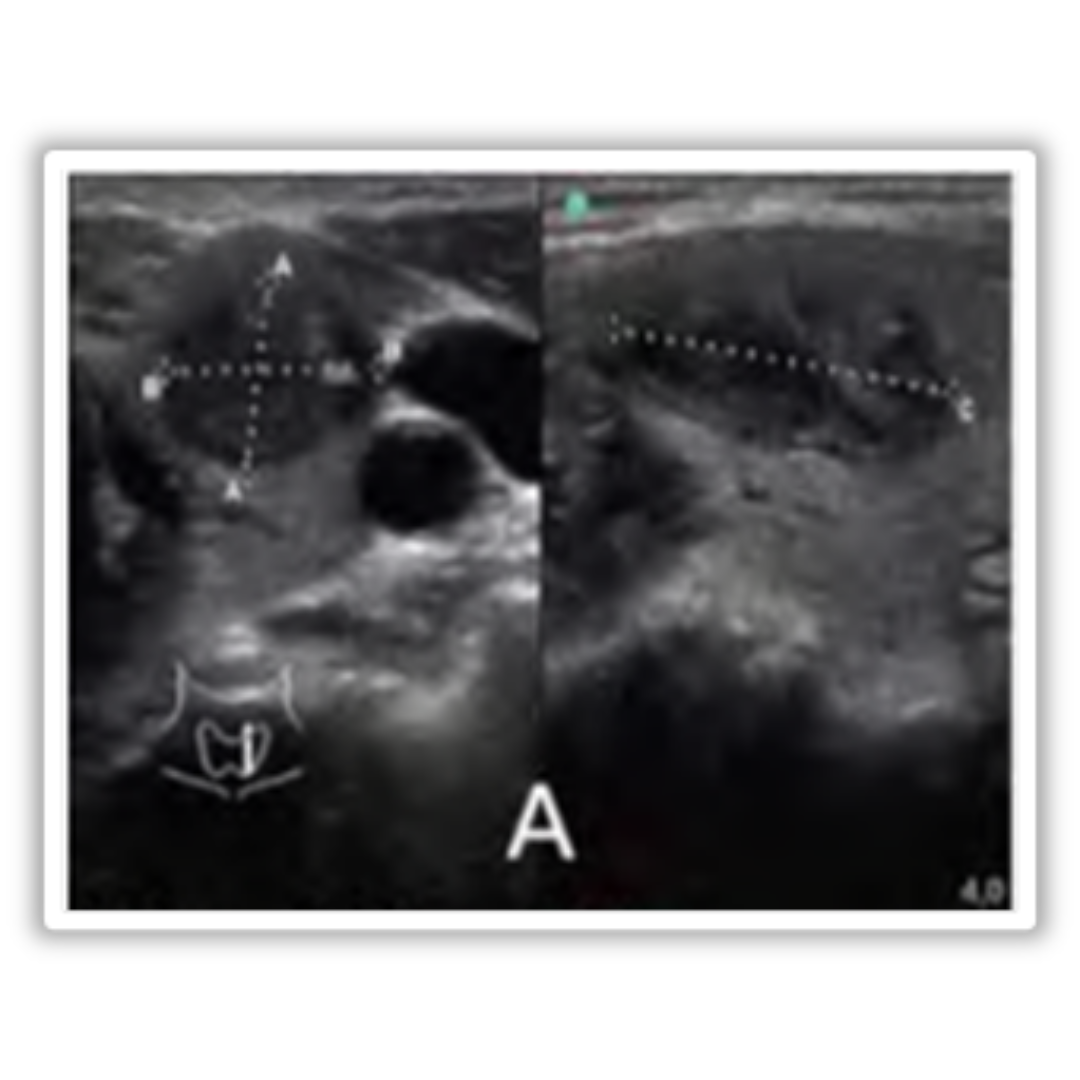
Figura 5. Ecografía transversal (A) y longitudinal (B) de una paciente de 33 años tras tiroidectomía y disección del compartimento central por CAP. Las Ecografías, obtenidas 21 días después de la cirugía, muestran un nódulo ecogénico alargado en el lecho de la lobectomía izquierda (flechas) simulando un remanente tiroideo. El nódulo ya no estaba presente en la ecografía de control realizada 14 meses después de la tiroidectomía, ya que la esponja gelatinosa Gelfoam se encontraba reabsorbida.
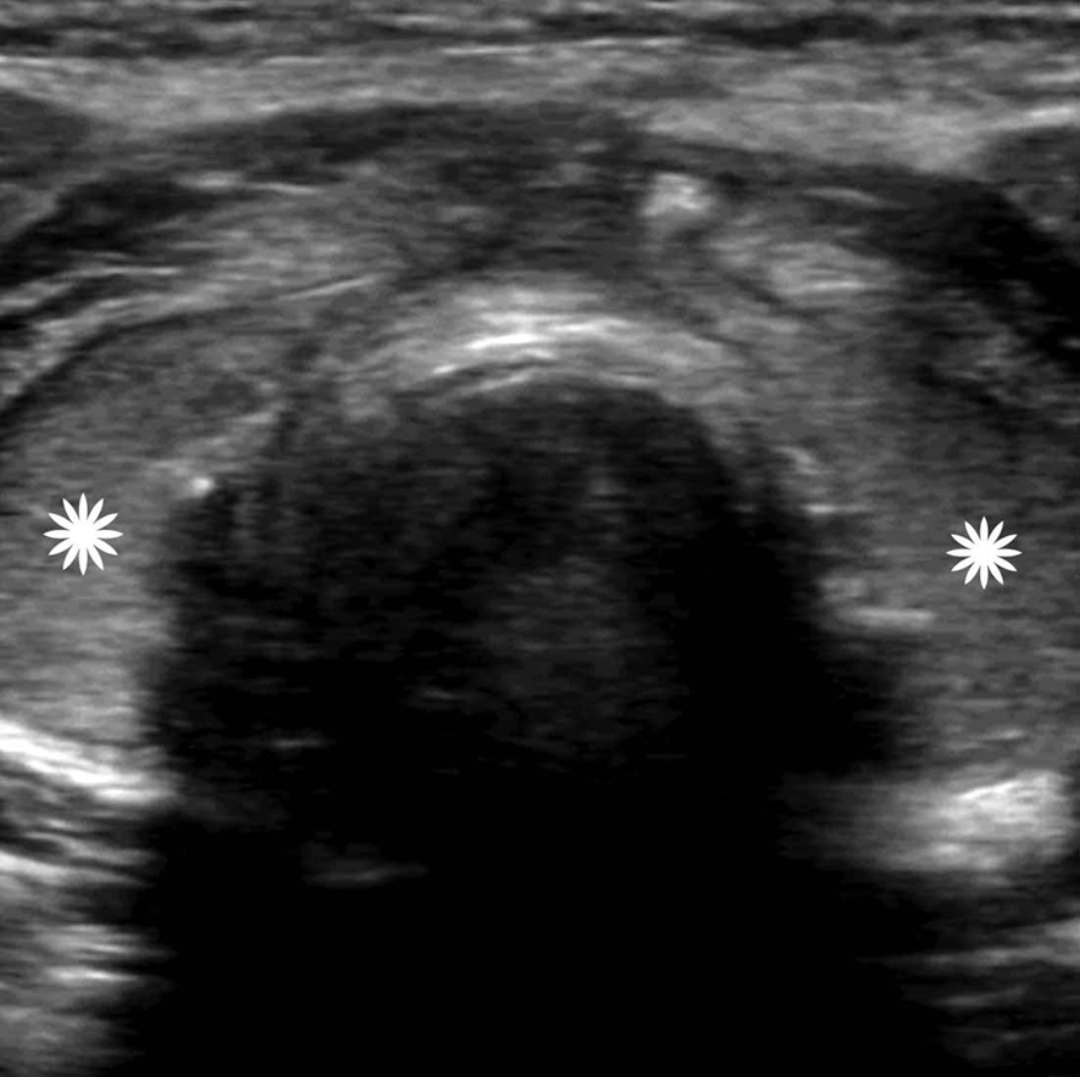
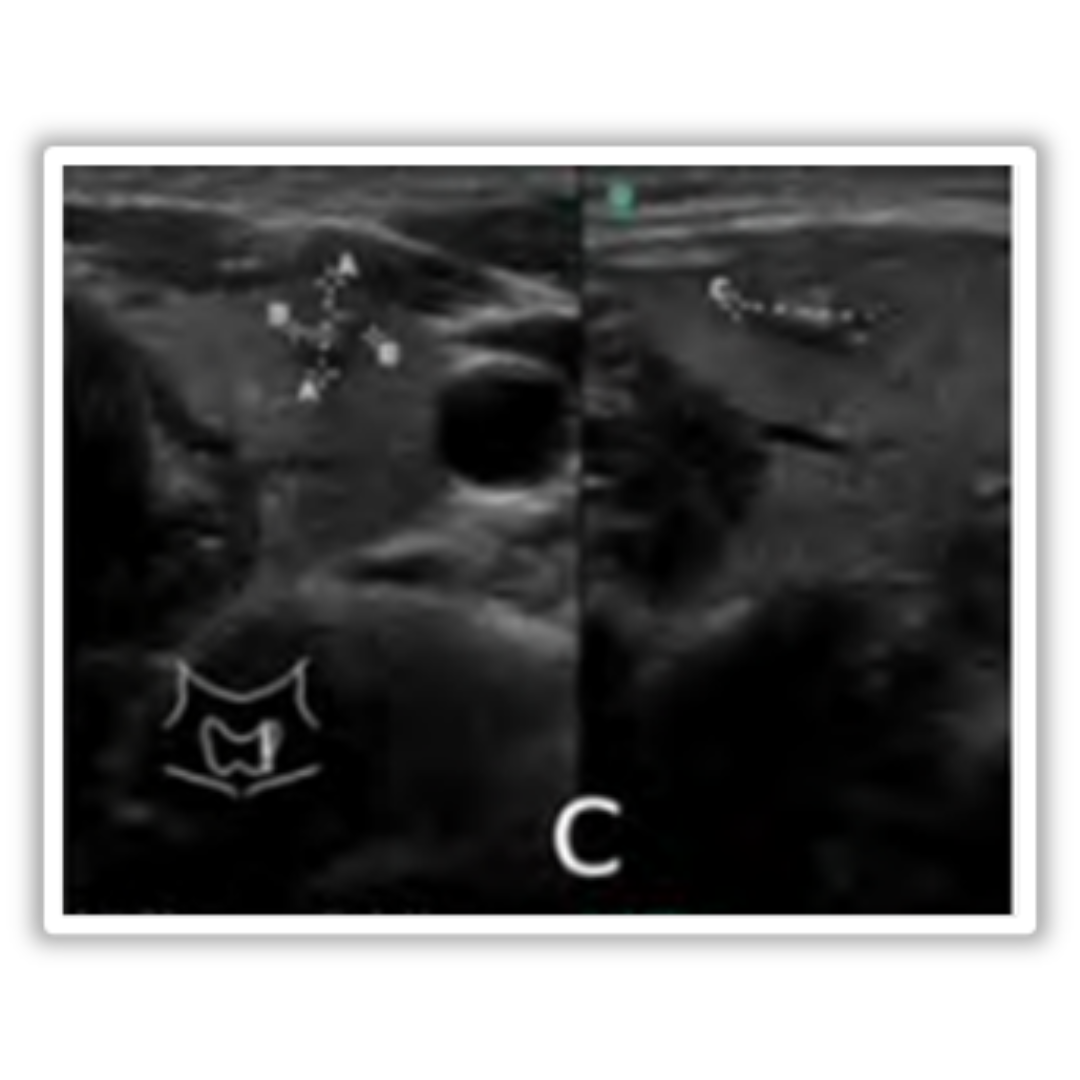
Figura 6. Ecografía transversal de una paciente de 36 años tras tiroidectomía y disección del compartimento central por CAP con punción con aguja fina no concluyente, pero con imagen positiva. La Ecografía, obtenida 25 días después de la cirugía, muestra imágenes ecogénicas uniformes en ambos lechos de tiroidectomía (asteriscos) sugerentes de presencia de agentes hemostáticos.
HALLAZGOS ECOGRÁFICOS TARDIOS POST TIROIDECTOMÍA
Se consideran tardíos aquellos hallazgos que se observan posterior a 12 meses de la tiroidectomía. Es importante considerar que no son hallazgos habituales, y el mayor rol de la Ecografía es pesquisar recidiva local y/o la presencia de ganglios metastásicos.
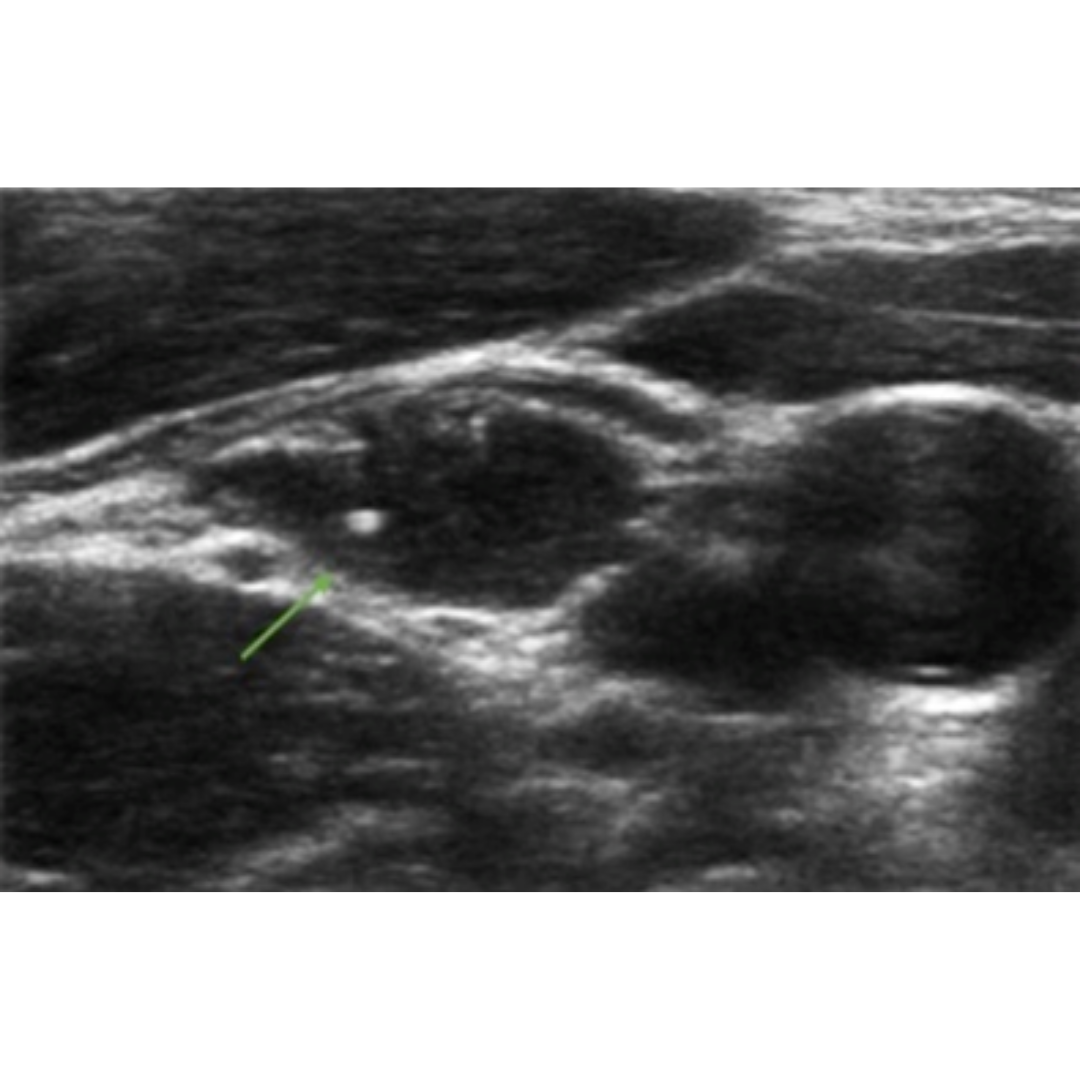
Granulomas
Los granulomas de sutura son lesiones inflamatorias benignas que pueden ocurrir en respuesta al material de sutura no absorbible, y se caracterizan patológicamente por una reacción al material extraño. Es importante diferenciarlos de procesos transversales prominentes de la columna cervical.
Hallazgos ecográficos:
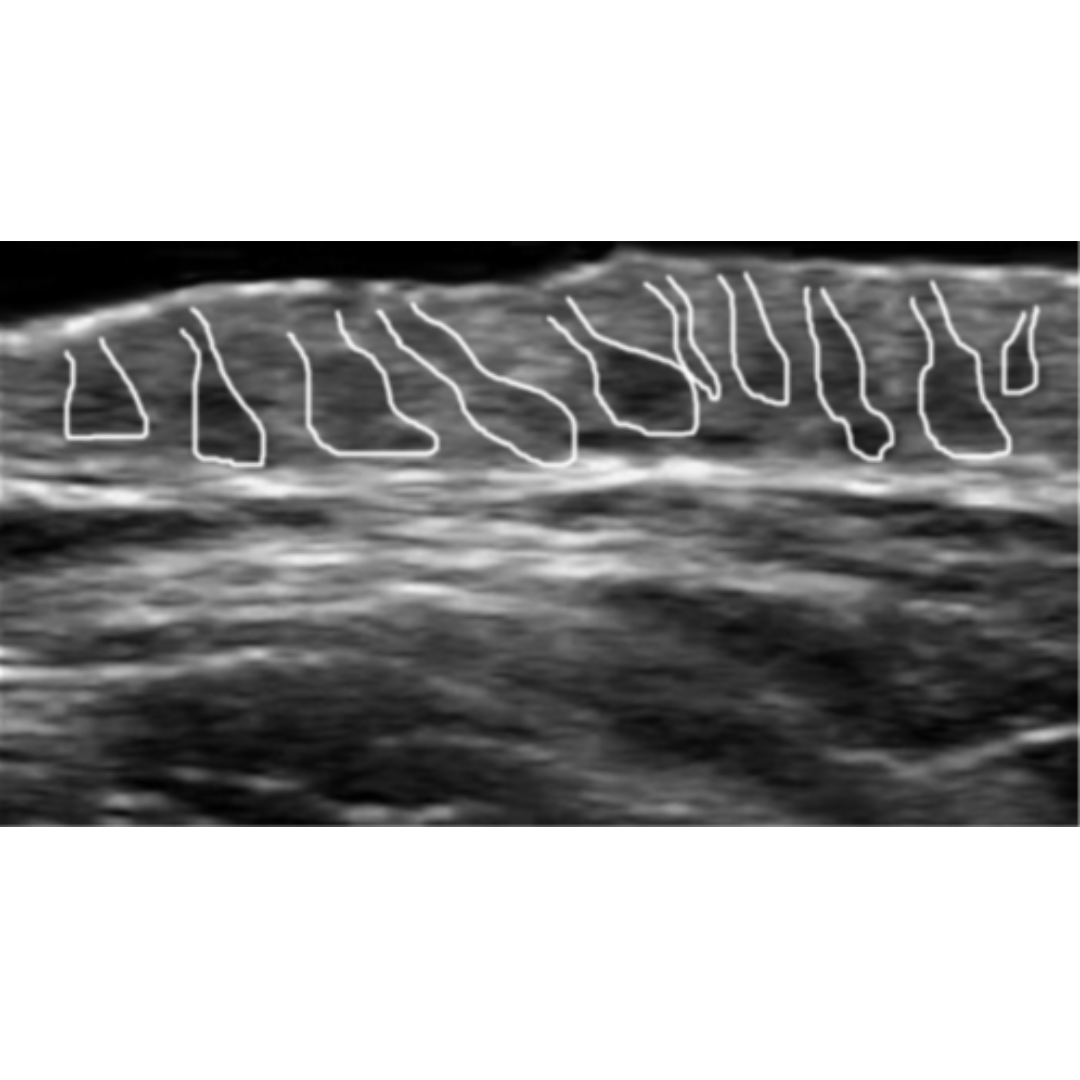
Generalmente son pequeños, sólo excepcionalmente alcanzan más de 10 mm de diámetro.
Presenta imágenes hiperecogénicas en su espesor, frecuentemente múltiples, con sombra acústica posterior.
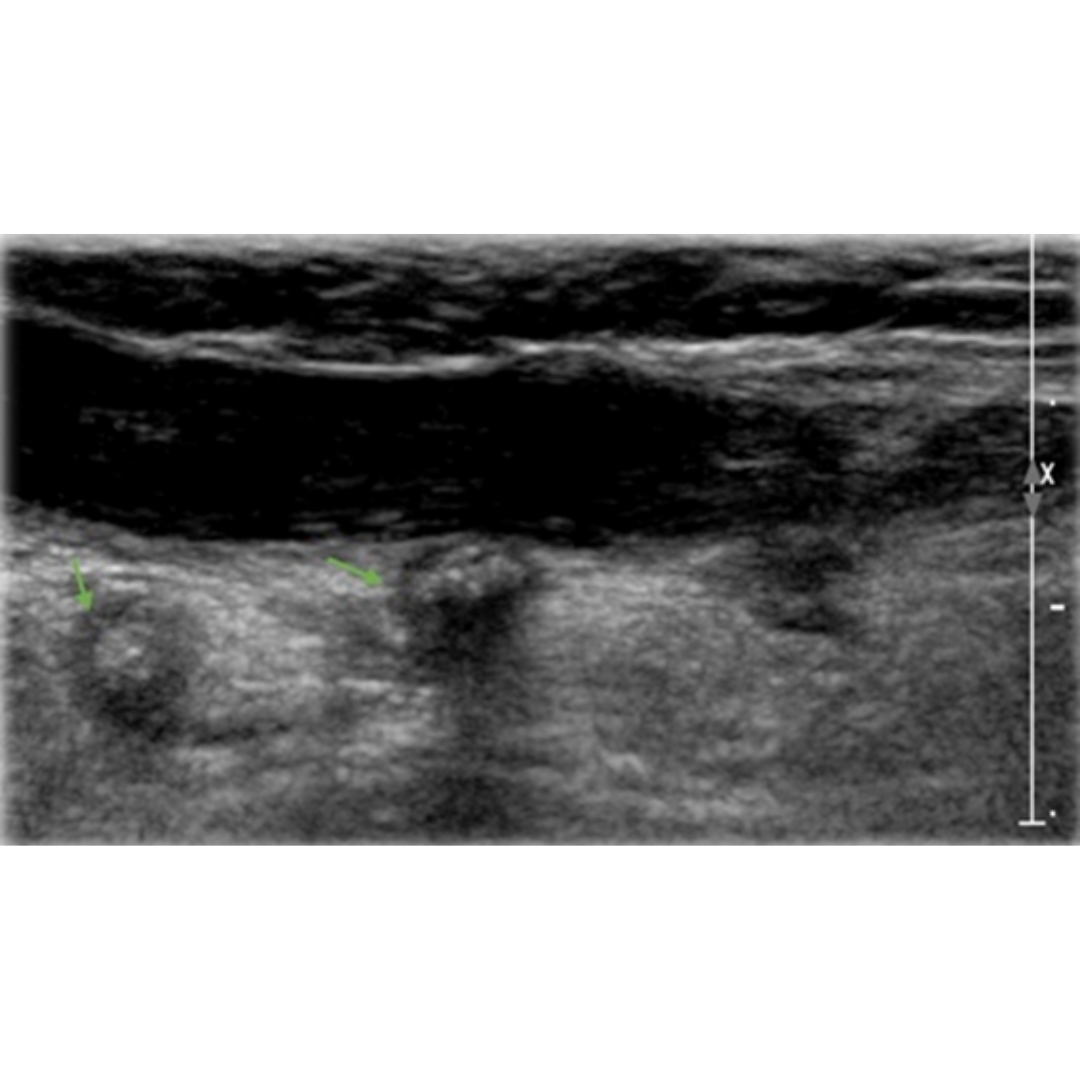
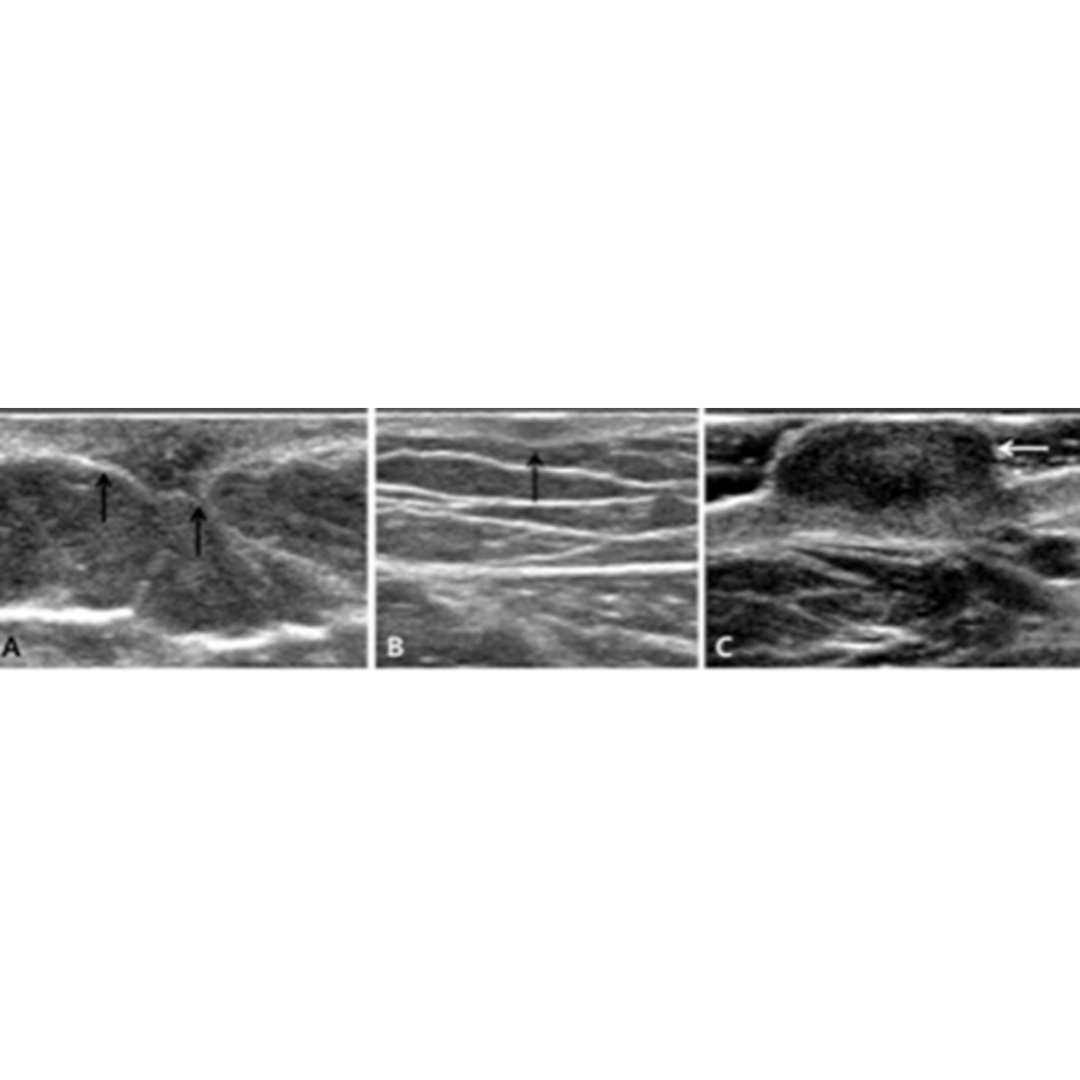
Figura 7. Flechas verdes indican granulomas, que se observan como imágenes hiperecogénicas con sombra acústica posterior y un tenue halo hipoecogénico.
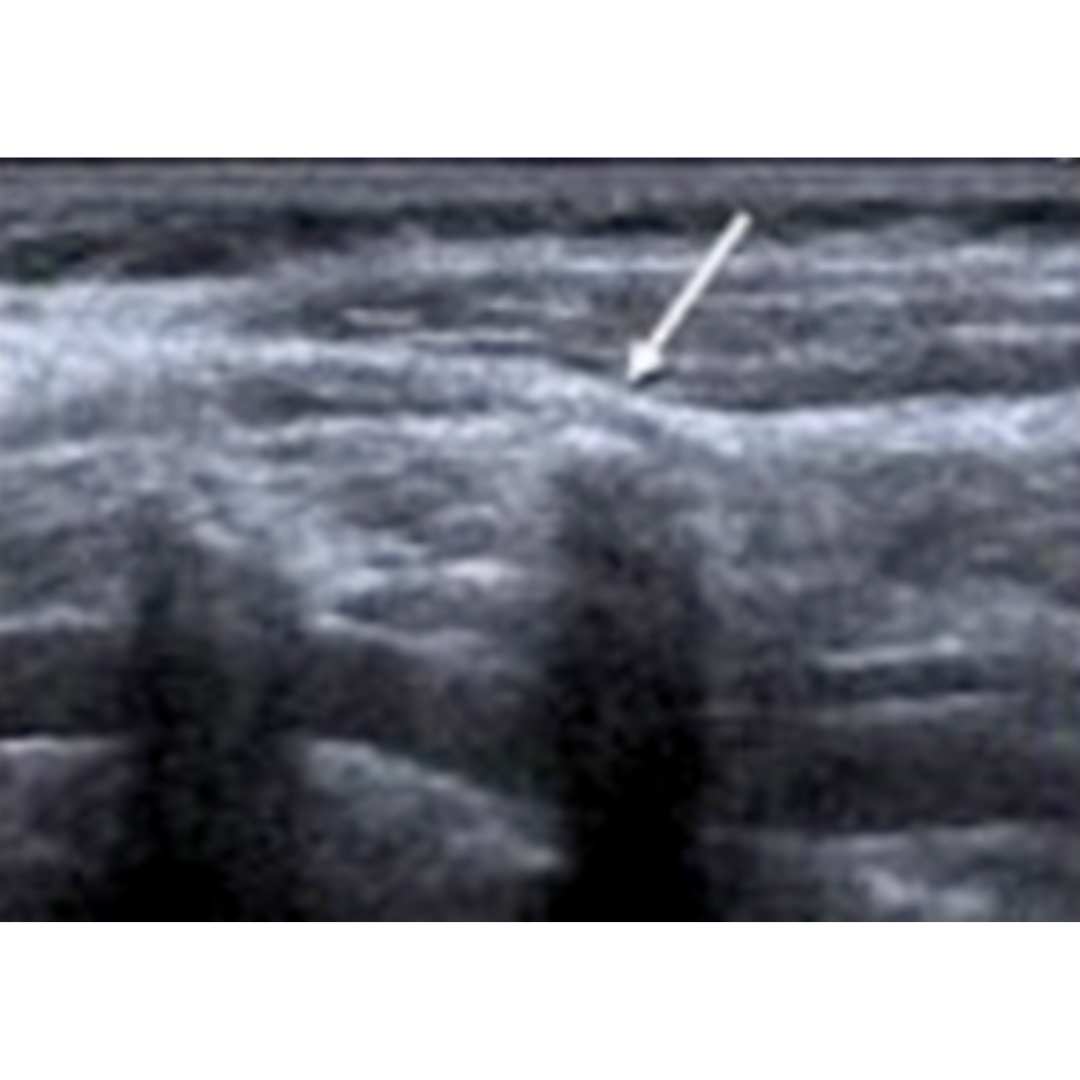
Figura 8. Se muestra proceso transversal C7 agrandado (flecha) como una variante anatómica.
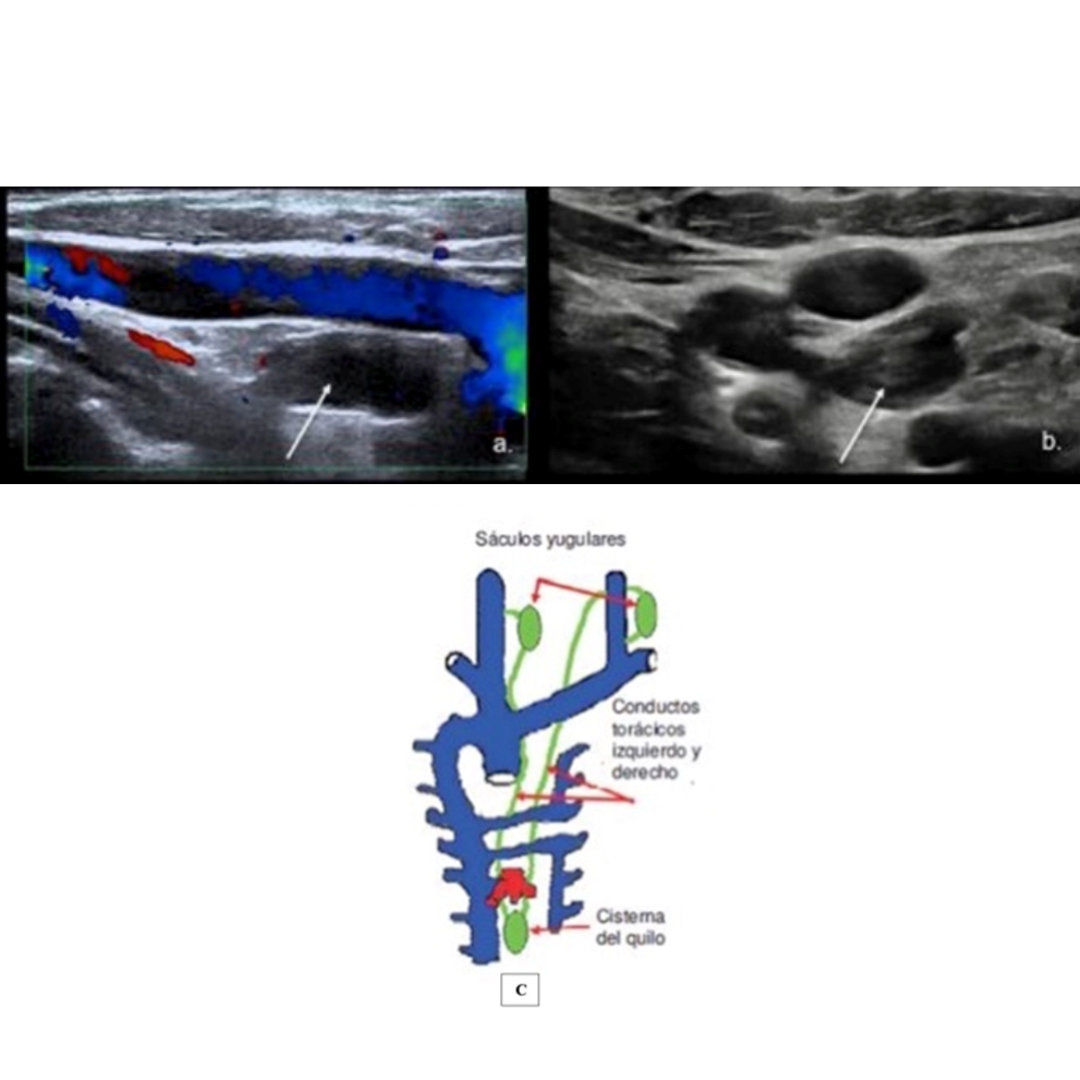
Aspecto terminal del conducto torácico
El conducto torácico es un vaso linfático que transporta linfa y grasas emulsionadas, drena la linfa de la mitad inferior del cuerpo y el tracto gastrointestinal hacia la vena yugular interna. Este conducto puede dilatarse y simular linfoadenopatías quísticas del compartimento lateral, la forma de diferenciarlos es buscando la unión del conducto torácico a la vena yugular interna. La dilatación de este conducto se puede observar en pacientes que tengan como antecedente clínico una linfadenectomía.
Hallazgos ecográficos:
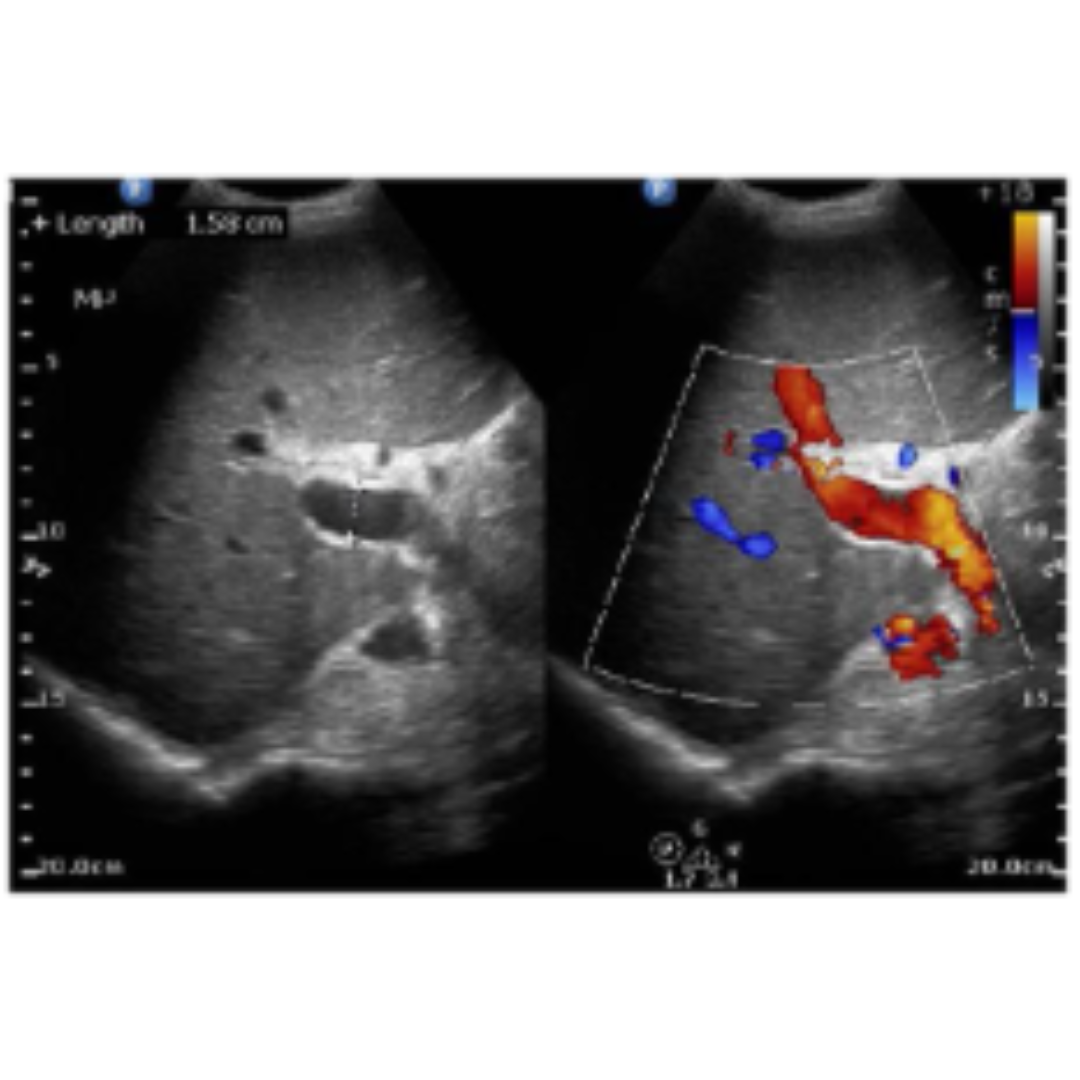
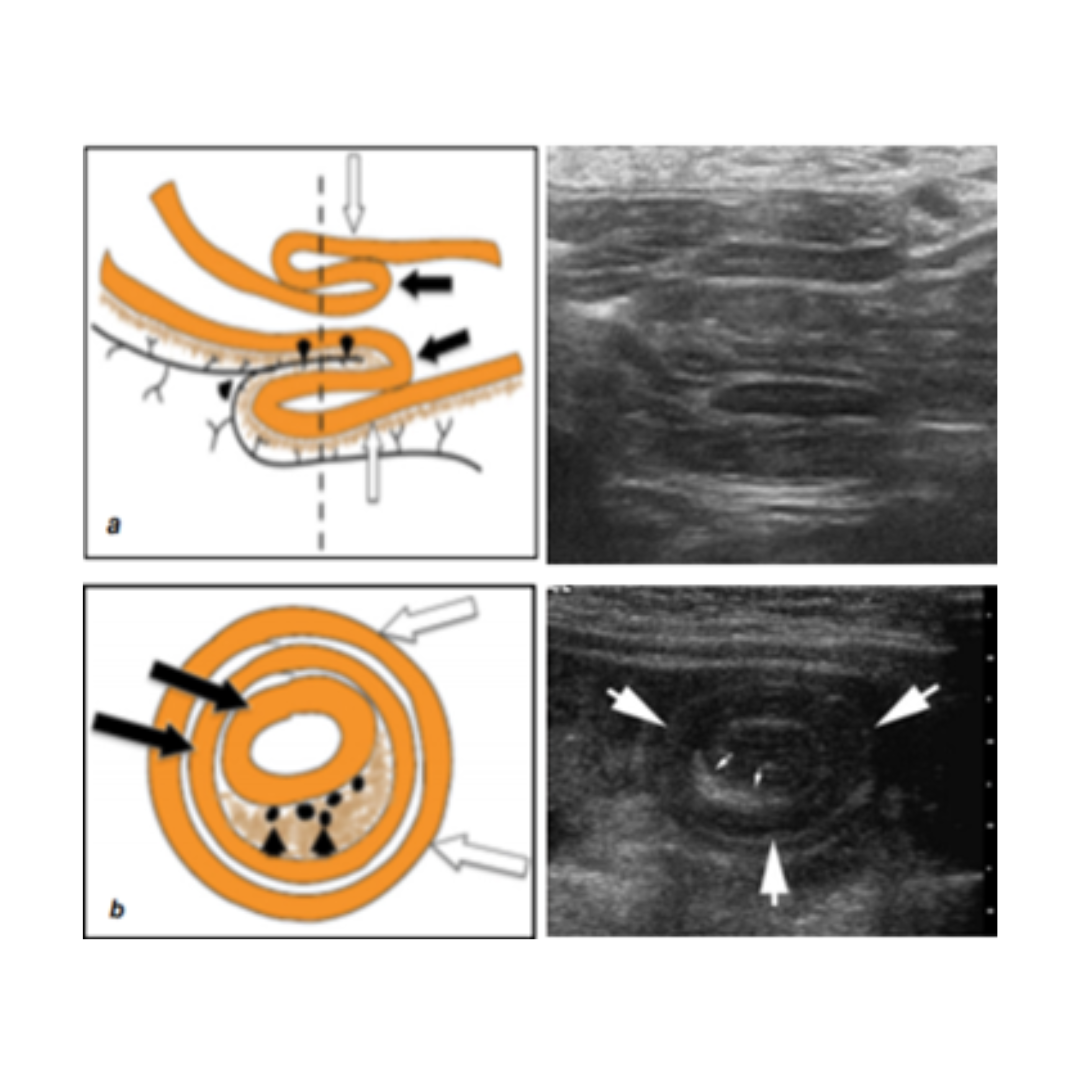
Conducto torácico anecogénico similar a un quiste ovalado, se debe demostrar su unión a la vena yugular interna.
Figura 9. Conducto torácico. Ecografía de cuello corte longitudinal (a.) y transversal (b.) muestra una estructura quística (flecha) que se extiende y se comunica con la vena yugular interna cerca del ángulo venoso. Se observan ecos internos debido al flujo (flecha en b). (c) Se observan los conductos torácicos derecho e izquierdo, que se conectan con los sáculos yugulares de cada lado, respectivamente.
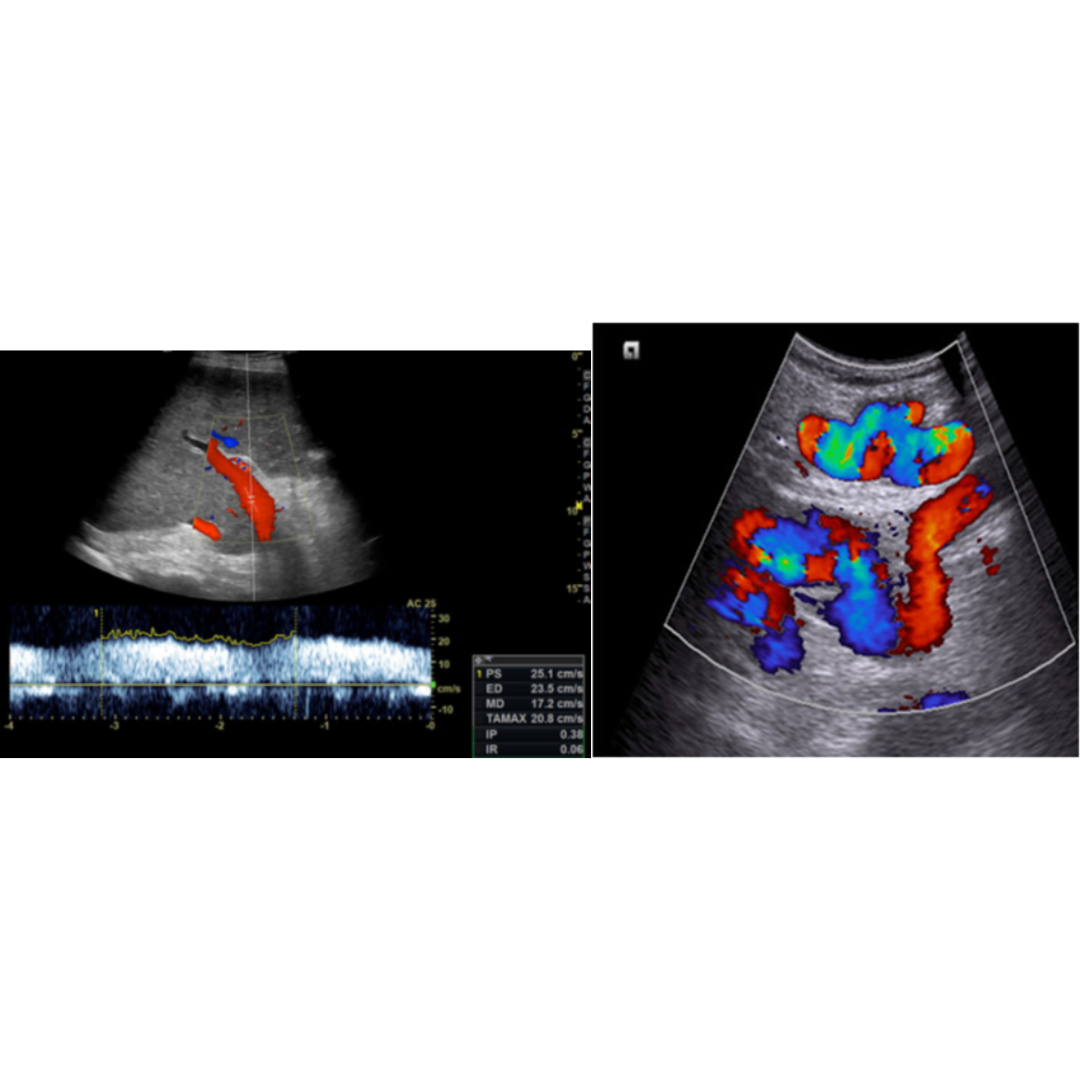
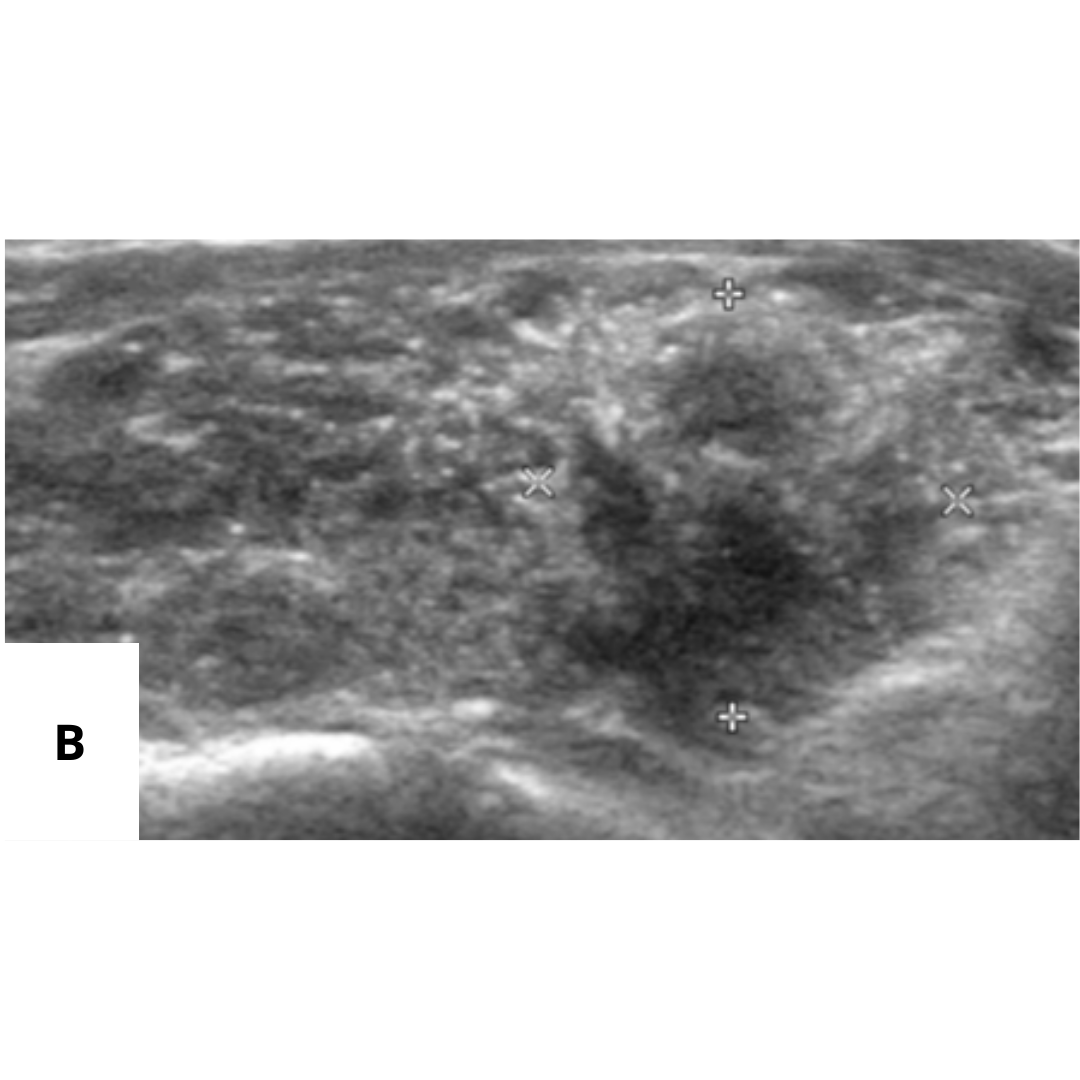
Recidiva local
Es la recurrencia del cáncer tiroideo en el lecho tiroideo, se observa como una lesión hipoecogénica, de contornos habitualmente irregulares, marcadamente vascularizado al Doppler color y que puede presentar calcificaciones en su espesor.
Figura 10. Ecografía de cuello cortes transversales, muestran un nódulo hipoecoico irregular de 9 mm en el lecho derecho de tiroidectomía.
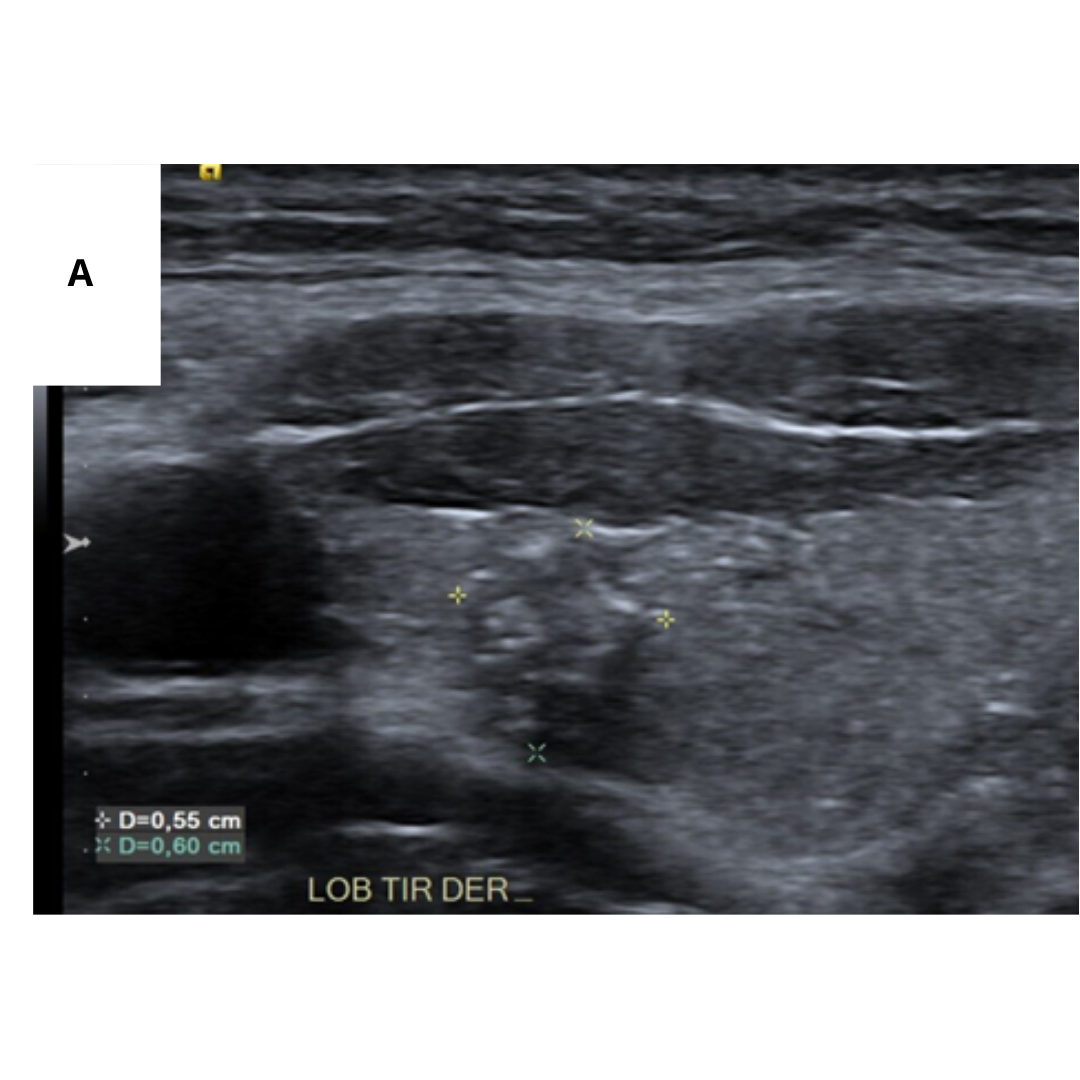
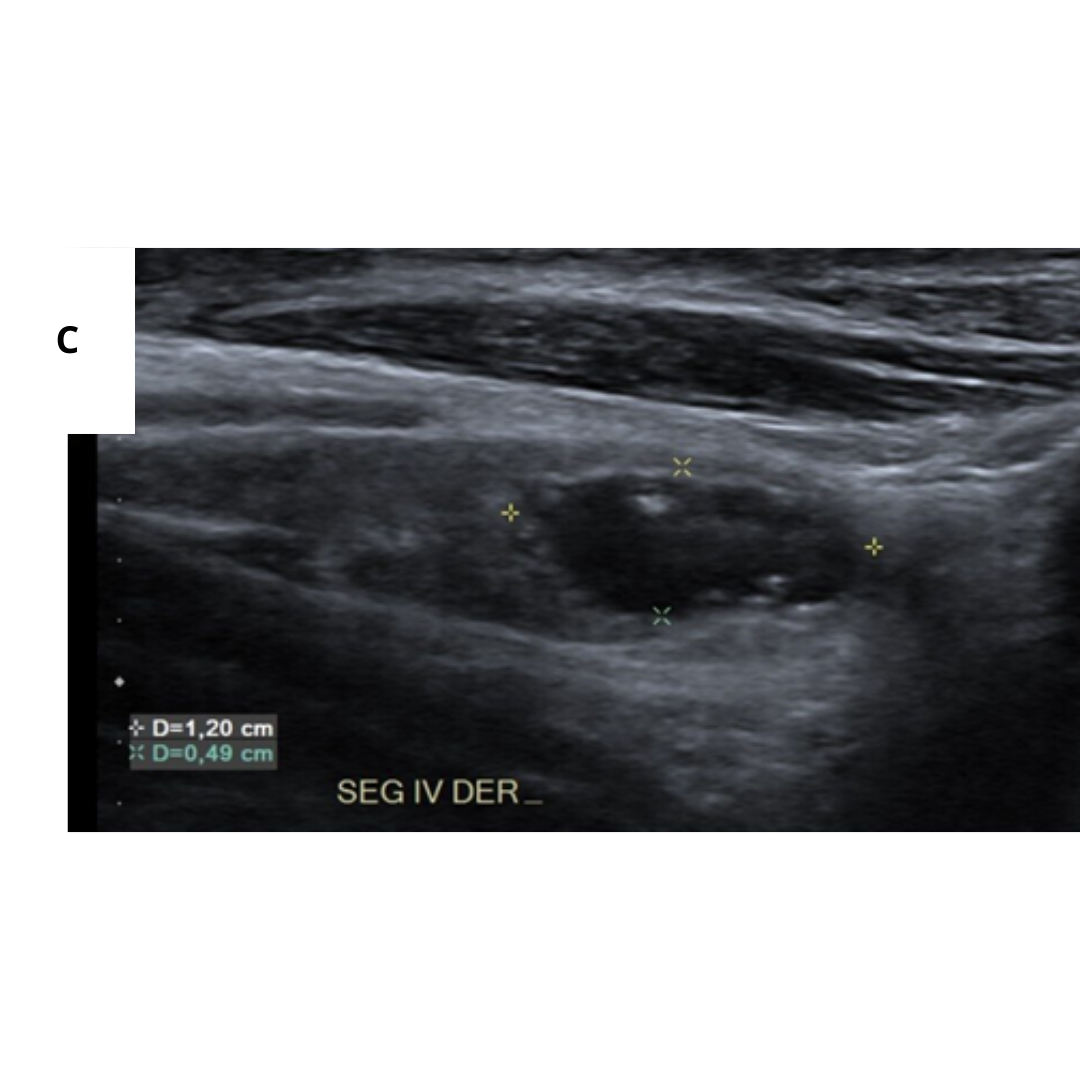
Adenopatías metastásicas
La mayor frecuencia de ganglios afectados está descrita en los segmentos III, IV y VI respectivamente, sin embargo, siempre debemos realizar un estudio acucioso de los segmentos cervicales, ya que en algunos casos se observa que no cumplen con este orden, saltándose a otros segmentos.
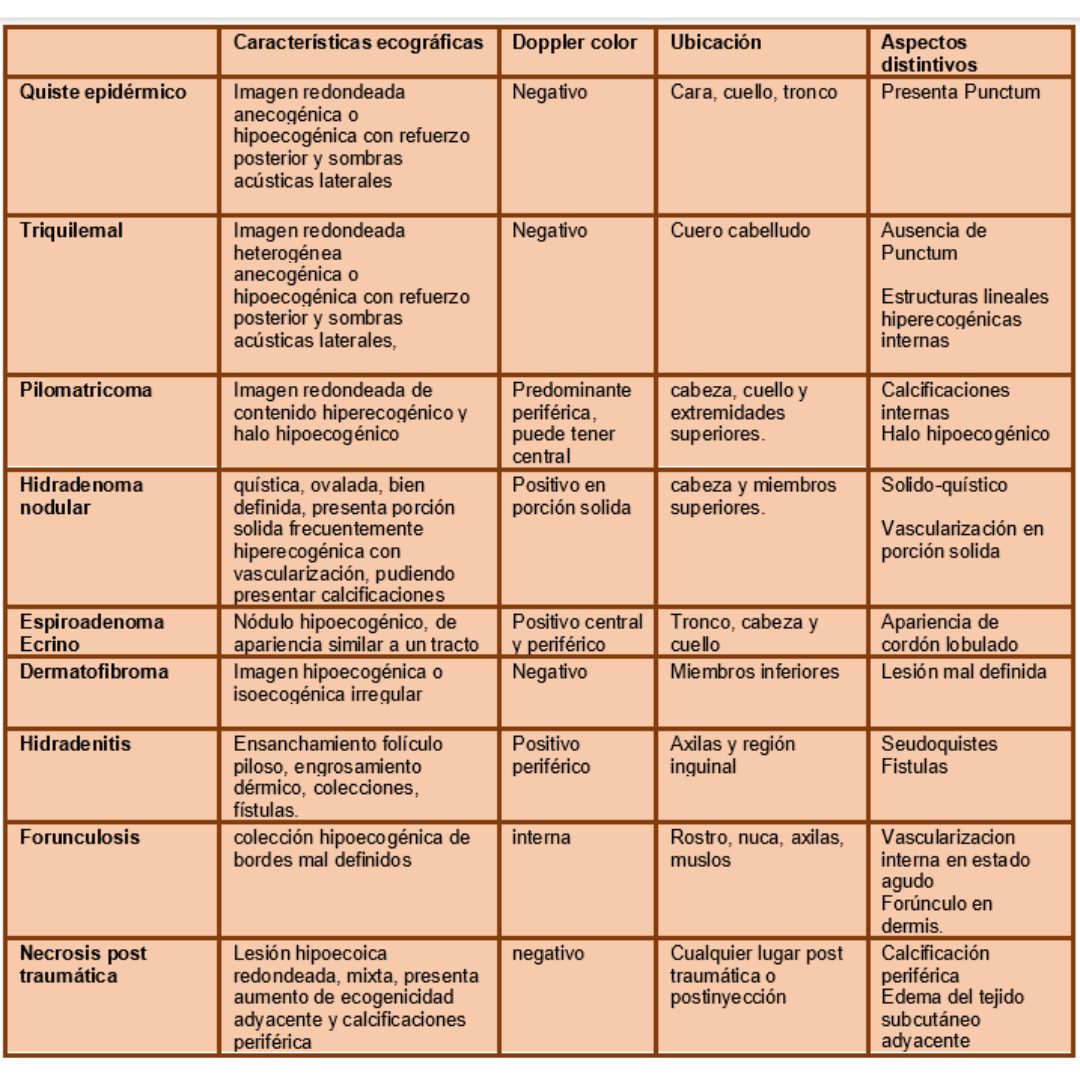
Es importante tener en cuenta como se observa una adenopatía metastásica por un Carcinoma Papilar, los hallazgos esperables están descritos en la tabla 1.
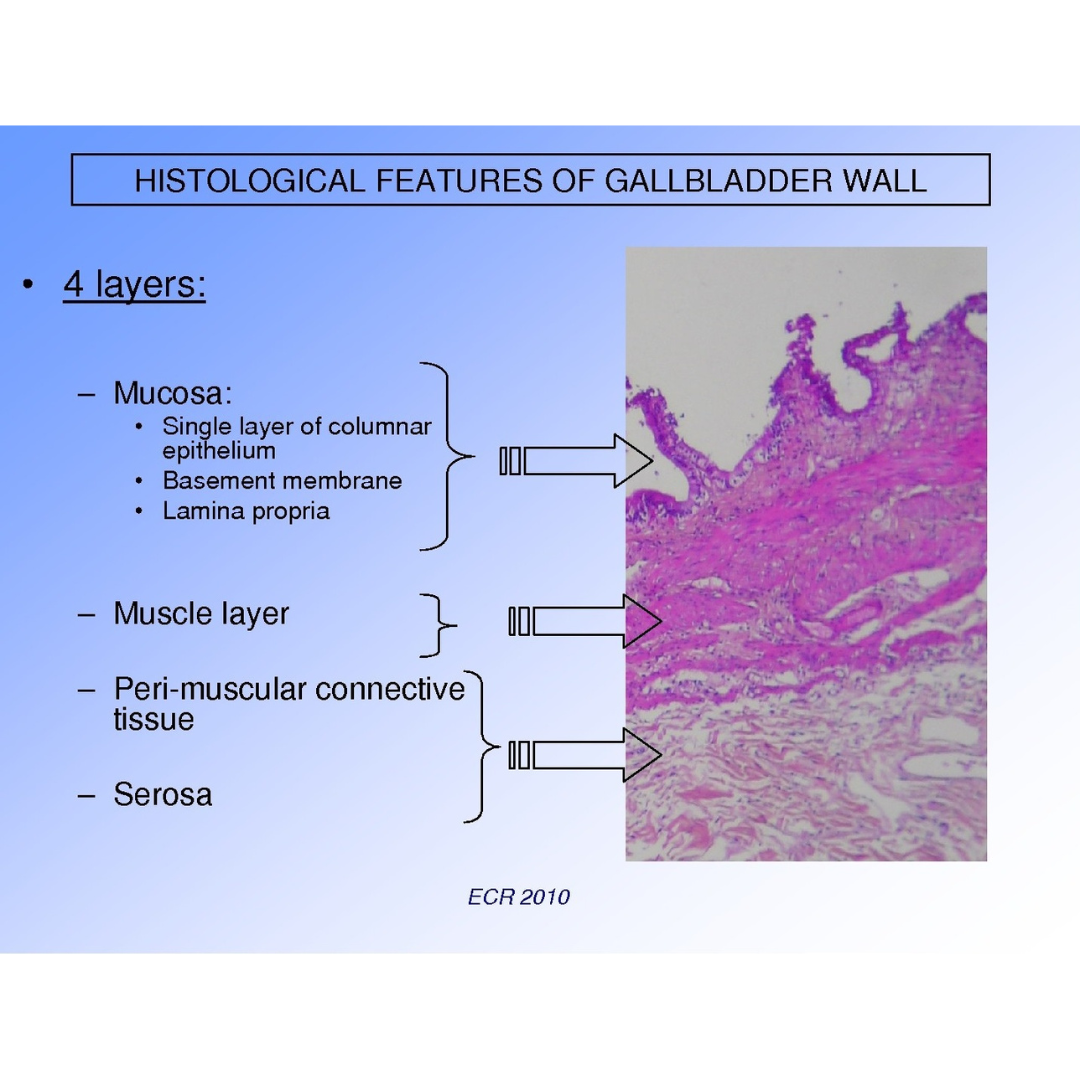
Tabla 1 Hallazgos ecográficos en adenopatías metastásicas
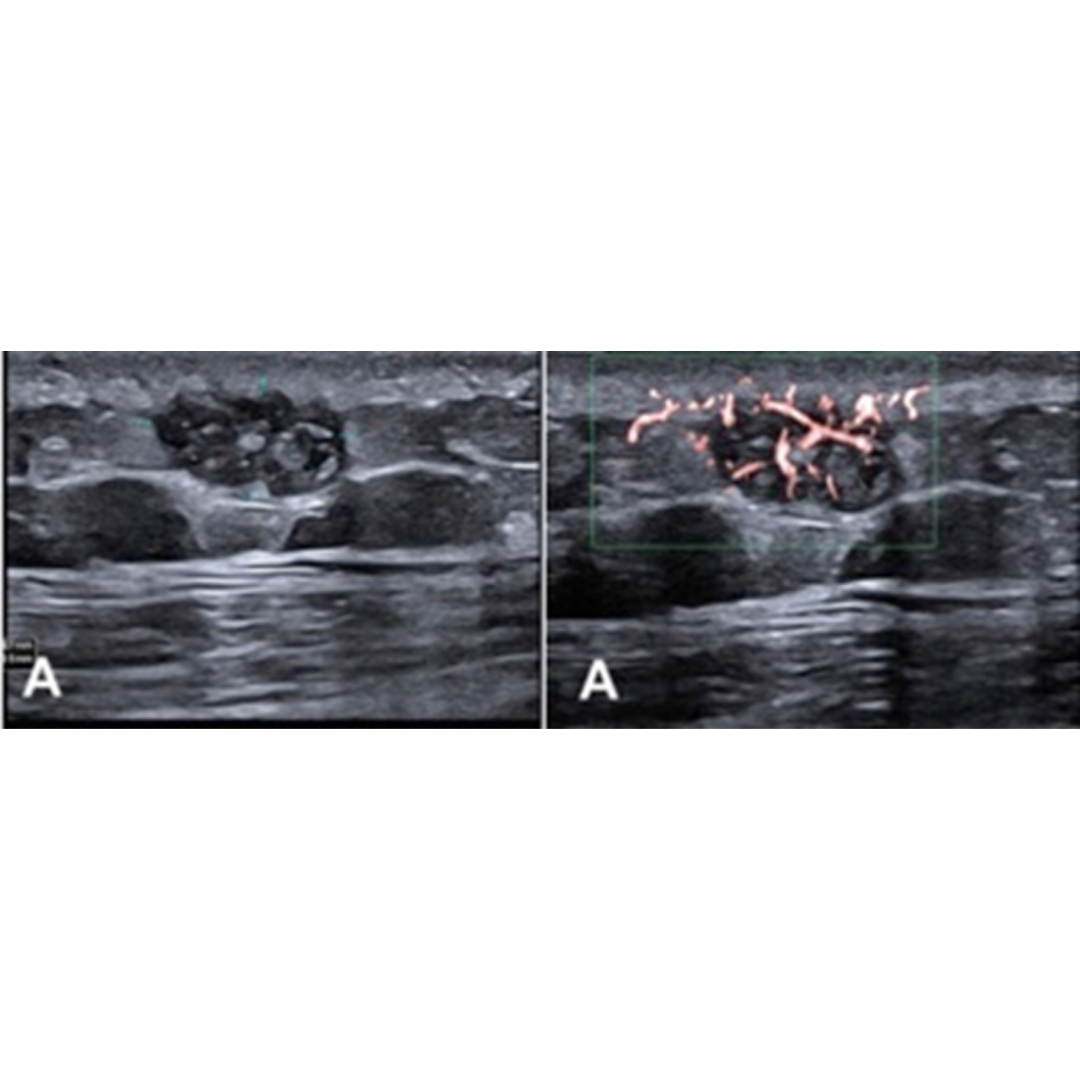
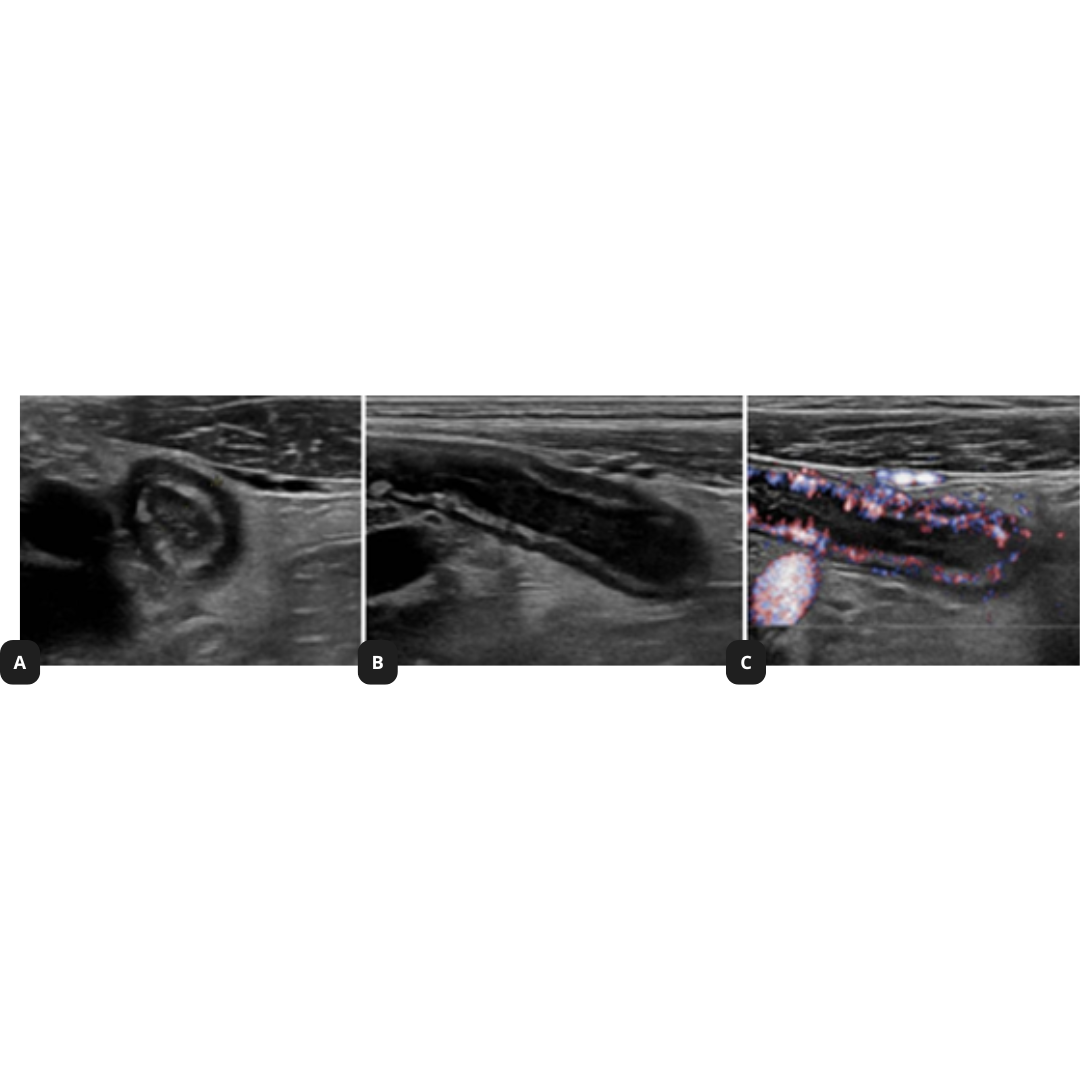
Figura 11. Ecografía de cuello en corte axial muestra características de los ganglios metastásicos. (a.) Ganglio linfático quístico con focos internos ecogénicos (flecha) que representan microcalcificaciones. No olvidar que la sombra del proceso transversal de la columna cervical (*), no debe confundirse con una calcificación de metástasis. (b.) Ganglio linfático hipoecogénico sin hilio graso.
Figura 12. Ganglio con pérdida de su hilio, con presencia de microcalcificaciones (flecha).
Remanentes Tiroideos
Son restos de tejido tiroideo que pueden observarse posterior a una tiroidectomía total en el lecho. Habitualmente se observarán con las mismas características de la glándula tiroidea que presentaba el paciente previo a su cirugía, es decir, es esperable que si un paciente tiene una tiroiditis marcada, el remanente también la tenga. También es esperable observar un remanente heterogéneo y disminuido de ecogenicidad en pacientes que recibieron una dosis de radioyodo.
Figura 13: Tejido remanente en corte longitudinal, se observa homogéneo hiperecogénico con aspecto de glándula tiroides.
Conclusión
El conocimiento de los hallazgos ecográficos y la historia clínica del paciente serán importantes para realizar un correcto seguimiento del paciente tiroidectomizado, considerando aquellos hallazgos normales o esperables post quirúrgicos, así como saber diferenciar las complicaciones tempranas y cambios tardíos de la glándula, como son los granulomas. Reconocer el rol que tiene la ecografía cervical en estos pacientes para pesquisar recidiva local o extensión ganglionar es relevante para realizar un examen acucioso, en búsqueda de ganglios metastásicos.
Referencias
Bronwyn E. Hamilton, Gary M. Nesbit, Neil Gross, Peter Andersen, David Sauer, and H. Ric Harnsberger “Characteristic Imaging Findings in Lymphoceles of the Head and Neck” American Journal of RoentgenologyVolume 197, Issue 6 December 2011-
Cuenca, J. H. A., García, D. M. A. H., Bermejo, J. M. S., Robles, C. R., Valentín, D. M. P. N., & Argüelles, D. C. F. (2021, 18 mayo). Ecografía de cuello de seguimiento después de la tiroidectomía para el carcinoma diferenciado de tiroides. https://piper.espacio-seram.com/index.php/seram/article/view/4689
Cesar/Br, U. R. M. M. M. C. C. M. R. T. R. D. G. F. M. J. A. D. L. B. M. T. S. A. P. K. L. <. <. P. <. P.-. S. S. <. P. S. P. <. (2014, 6 marzo). Cervical Level IV has major incidence of Lymph nodes Metastases after thyroid cancer? ECR 2014 EPOS. https://epos.myesr.org/poster/esr/ecr2014/C-0422/Aims%20and%20objectives#poster
Lisbon/PT, U. V. (2015, 4 marzo). Central role of US in imaging evaluation of patients submitted to total thyroidectomy for cancer disease. ECR 2015 EPOS. https://epos.myesr.org/poster/esr/ecr2015/C-1716
Miah CF, Zaman JA, Simon M, Davidov T, Trooskin SZ. The utility of lymph node mapping sonogram and thyroglobulin surveillance in post thyroidectomy papillary thyroid cancer patients. Surgery. 2014;156(6):1491-7.
Qureishi A, Silva P, Lamyman A, Cox G. Cervical lymphocoele: a simple solution for a complicated problem. Ann R Coll Surg Engl. 2012 Mar;94(2):e79-80. doi: 10.1308/003588412X13171221500826. PMID: 22391360; PMCID: PMC5827239.
Peña, E., & Zuñiga, A. (s. f.). Una variación anatómica: la desembocadura aberrante del conducto torácico. http://www.scielo.org.co/scielo.php?script=sci_arttext&pid=S0120-41572009000200005
Diagnósticos Diferenciales Ecográficos de Quistes Epidérmicos
TM Romina Arriagada - TM Elizabeth Vidal
Objetivo
La ecografía ha demostrado ser una herramienta útil para el estudio de lesiones ubicadas en la dermis e hipodermis, por lo que es frecuentemente solicitada para conocer las características de las lesiones si son sólidas, quísticas, mixtas etc. Dentro de las lesiones más frecuentes está el quiste epidérmico. Sin embargo, existe un universo amplio de lesiones, que a pesar de no ser tan frecuentes es necesario que el ecografista sepa demostrar aquellas características que la diferencian de un quiste epidérmico y que las posiciona en otro diagnóstico. A continuación, revisaremos lesiones que tienen similitud con el quiste epidérmico.
REVISIÓN ECOGRÁFICA
Los quistes epidérmicos tienen mayor prevalencia en adulto que en niños, resultan de una inclusión espontánea o adquirida de epitelio escamoso queratinizado en dermis o hipodermis. Los pacientes señalan bulto compresible, no doloroso habitualmente, de crecimiento lento y aislado, bajo ecografía los hallazgos serán los descritos en tabla 1.
QUISTE TRIQUILEMAL
Son quistes asintomáticos y benignos. Corresponde al segundo quiste con mayor frecuencia. El 90% se ubica en cuero cabelludo. Su etiología es principalmente el traumatismo de la unidad pilosebácea. Producen alopecia en la zona donde se encuentran. Predominio femenino. Son generalmente múltiples (66% de los casos).
Hallazgos ecográficos
Suelen tener una apariencia heterogénea, en su mayoría hipoecogénica, no vascularizan al Doppler, presentan realce acústico posterior, nódulo liso, no conectado con la epidermis por lo que no presentan punctum, presentan calcificaciones en su interior, que se observarán como líneas hiperecogénicas mejor o peor definidas (imagen 1).
Imagen 1: A y C lesión nodular heterogénea con presencia de calcificaciones, refuerzo acústico posterior ubicada en cuero cabelludo. B) Quiste triquilemal asociado a alopecia
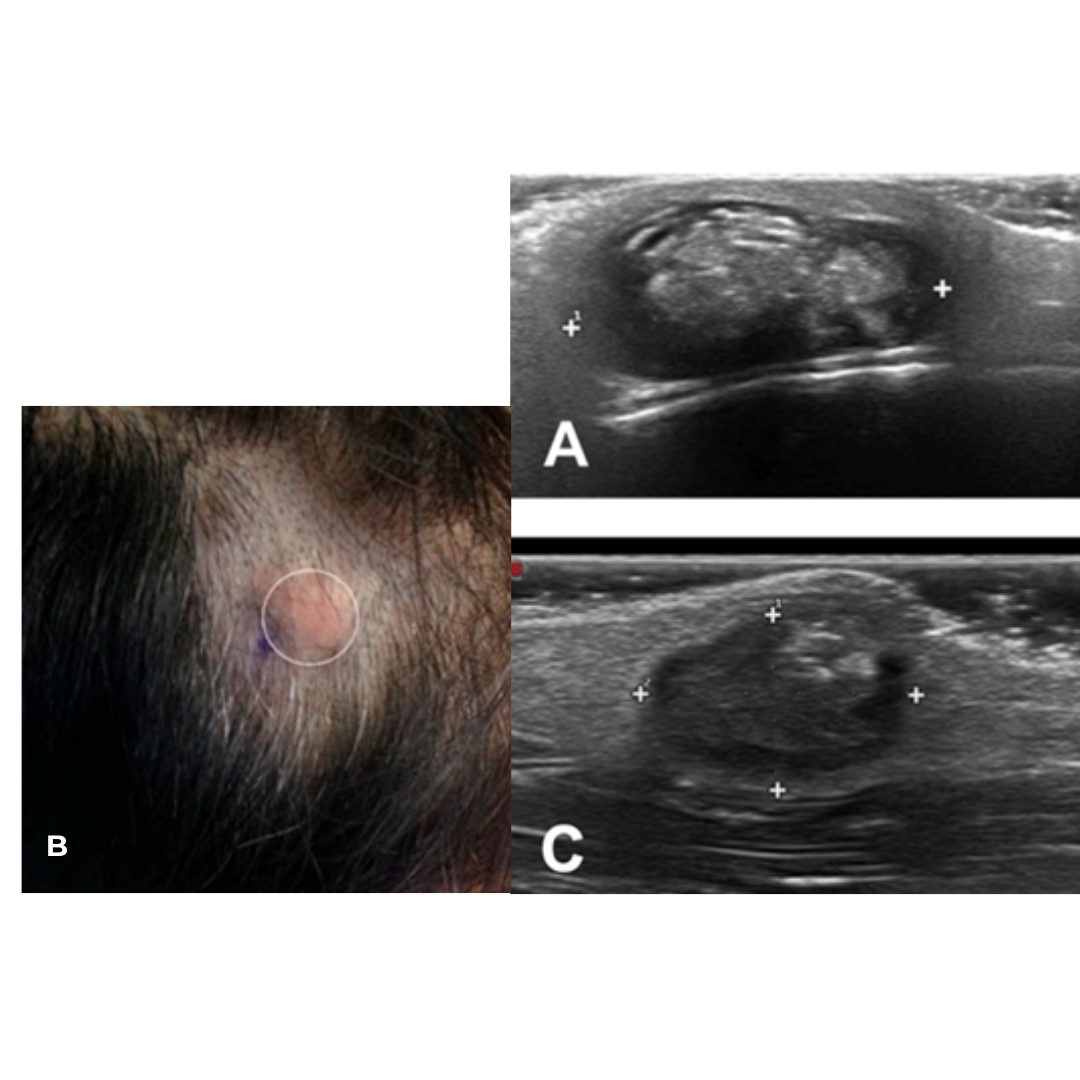
PILOMATRICOMA
Tumor benigno que deriva de estructuras del folículo piloso, el 60% de los tumores aparecen en las dos primeras décadas de vida. Se localizan en cualquier parte, pero más del 50% en cabeza, cuello y extremidades superiores.
En la exploración física tendrá una consistencia firme dependiendo del grado de calcificación, con un tinte rojo, blanquecino o azulado.
Presenta un signo clínico muy útil para diferenciarlo y es “la tienda”, este signo aparece al comprimir el nódulo con los dedos generándose un pliegue en su superficie (imagen 3). Presenta crecimiento lento, indoloro.
Hallazgos ecográficos
Nódulo bien definido, heterogéneo, predominantemente hiperecogénico, con halo fino hipoecogénico, con puntos hiperecogénicos internos sugerentes de calcificaciones internas, pueden presentar áreas quísticas internas, sombra acústica posterior, vascularización al Doppler se describe un 70 % de los casos periférica, pero también podemos encontrarla central y mixta (imagen 4).
Imagen 3: Signos de la tienda al realizar compresión en un pilomatricoma
Imagen 4: A) Pilomatricoma, nódulo solido heterogéneo, con área quística interna, halo hipoecogénico, con microcalcificaciones, sombra acústica posterior. B) patrón vascular variable con vascularización periférica y central.
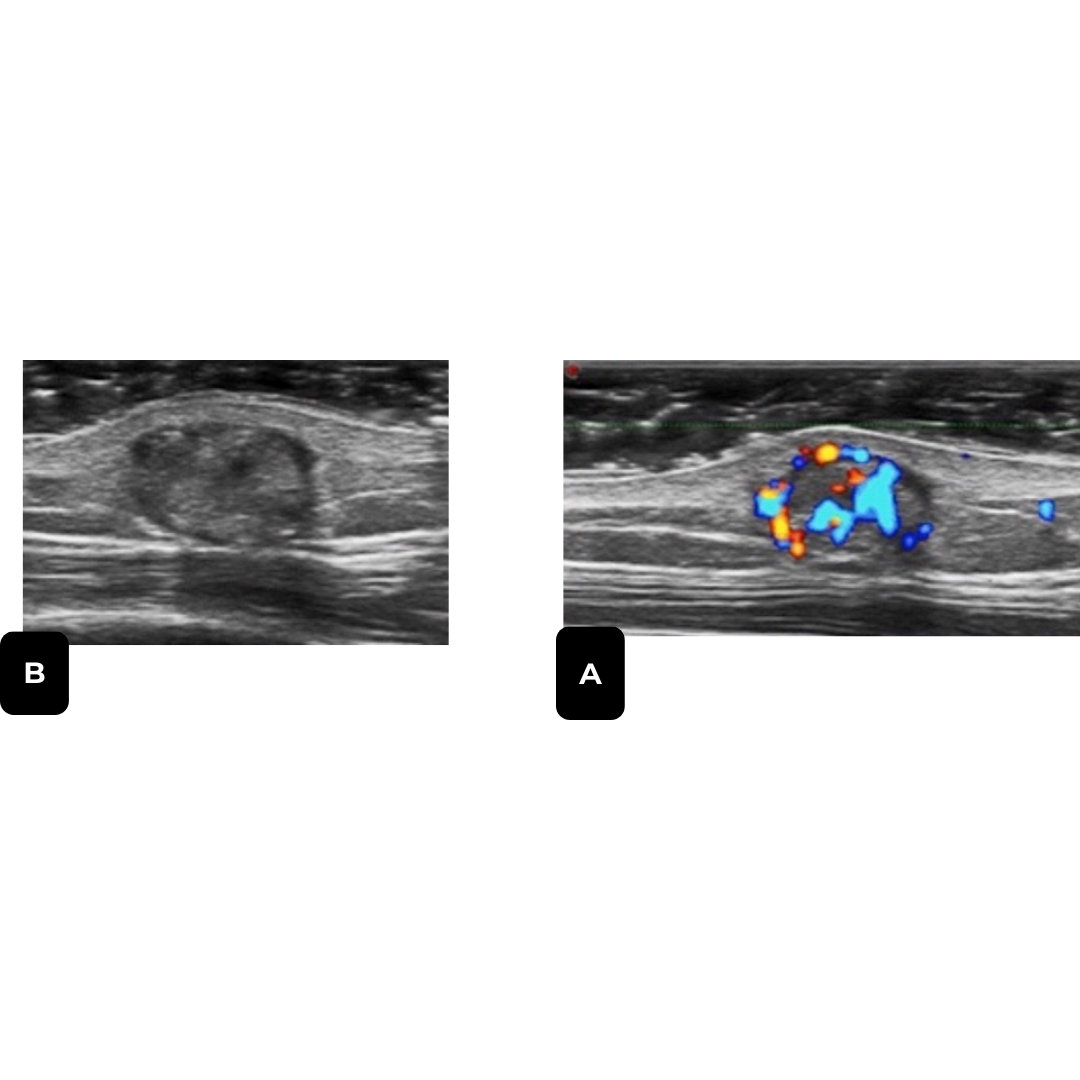
HIDRADENOMA NODULAR
Tumor anexial benigno e infrecuente, asintomático sin embargo puede presentarse doloroso y con sangrado, de crecimiento lento. Afecta principalmente a mujeres entre la 4ª y 5ª década de vida, se localiza en cabeza y miembros superiores.
Hallazgos ecográficos
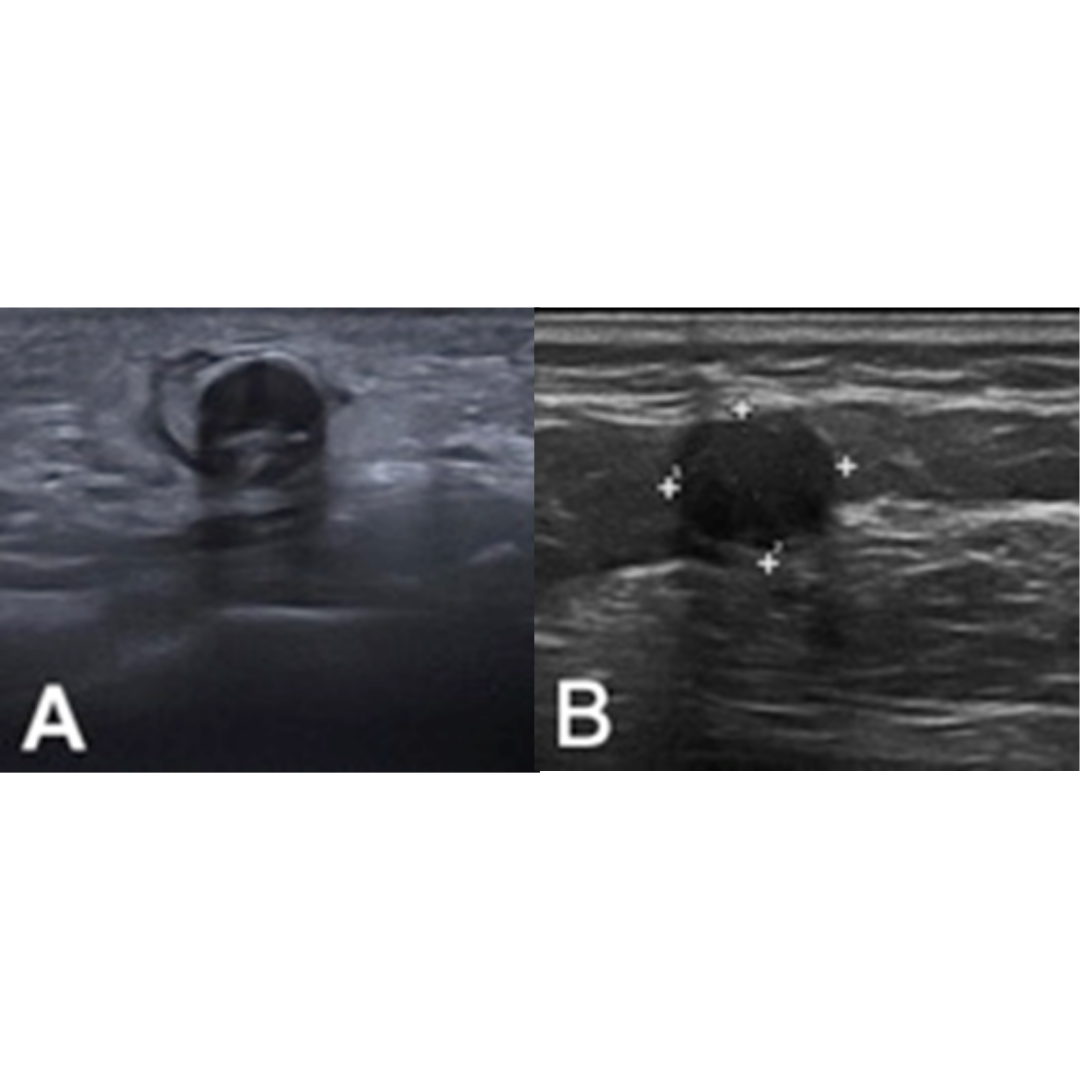
Ecográficamente se define como una lesión dermo-hipodérmica de naturaleza quística, ovalada, bien definida, presenta porción solida frecuentemente hiperecogénica con vascularización, pudiendo presentar calcificaciones (imagen 5).
Imagen 5: A) Lesión dermo-hipodérmica, ovalada, anecoica, con una zona hiperecogénica triangular que protruye desde su pared (asterisco). B) Aumento de flujo a nivel periférico y en la porción sólida triangular (modo Doppler).
ESPIROADENOMA ECRINO
Tumor benigno poco frecuente de la glándula sudorípara ecrina, puede presentarse a cualquier edad, teniendo predilección por la segunda cuarta década de vida. Se presentan en tejidos blandos, con crecimiento lento con un tamaño que varía entre 1 a 10 cm, pueden ser sintomáticos presentando dolor paroxístico.
Hallazgos ecográficos
Nódulo hipoecogénico, de apariencia similar a un tracto lobulado, bien definido en hipodermis, al Doppler presenta flujo periférico y central (imagen 6).
Imagen 6: Nódulo hipoecogénico ubicado en hipodermis, de presentación lobulada, con flujo al Doppler color interno.
DERMATOFIBROMA
Tumor benigno asintomático, se localiza de forma electiva en los miembros inferiores, presentación en adultos frecuentemente en mujeres, se localiza principalmente en extremidades inferiores seguidas por las superiores, el tronco y la cara, clínicamente se presenta como un nódulo firme de color marrón.
Hallazgos ecográficos
Lesión dermohipodérmica irregular, puede presentar espiculaciones, hipoecogénico respecto a la dermis, al Doppler no suelen vascularizar (Imagen 7)
Imagen 7: Diversos hallazgos ecográficos de dermatofibromas. (a) La ecografía de la pared abdominal en una mujer de 27 años muestra una lesión irregular que afecta la dermis y la capa de grasa subcutánea. Se observa espiculación de los márgenes. (b) La ecografía del muslo derecho en un hombre de 38 años muestra una lesión dérmica ovalada mal definida de 4 mm. (c) La ecografía del tobillo izquierdo en un hombre de 40 años muestra una lesión protuberante ubicada en la capa dérmica superficial.
HIDRADENITIS SUPURATIVA
Se caracteriza por la aparición de lesiones inflamatorias dolorosas y profundas en áreas corporales donde existen glándulas apocrinas, suelen tener periodos dolorosos y no dolorosos.
Hallazgos ecográficos
Ensanchamiento de folículo piloso(signo de Champange), engrosamiento dérmico, colecciones hipoecogénicas rodeadas o no con edema del tejido subcutáneo, las colecciones pueden extenderse más allá de hipodermis a través de trayectos fistulosos (imagen 8).
Imagen 8: A) Colección hipoecogénicacon trayecto fistuloso y edema adyacente (punta de flecha). B) Engrosamiento cutáneo. C) Ensachamiento de folículo pilosos “singo Champange”
FORUNCULOSIS
Es un folículo piloso infectado causado por Sthaphylo Aureus puede presentarse con absceso con extensión a hipodermis. Es una lesión dolorosa, enrojecida y con secreción purulenta, se diferencia clínicamente y ecográficamente de la foliculitis ya que esta última afecta al folículo piloso solo al nivel del ostium (superficial), en cambio la forunculosis es una lesión profunda que afecta todo el folículo piloso (ostium, istmo y bulbo) e incluso se extienden hasta hipodermis con colecciones.
Hallazgos ecográficos
Colección hipoecogénica de bordes mal definidos, podría comunicados con diferentes trayectos pilosos si existieran más de un forúnculo (carbuncos) y aumento de vascularización interno y periféricos. Genera Afectación del tejido celular subcutáneo adyacente observándose hiperecogénico adyacente a la lesión (imagen 9).
Imagen 9: Forunculosis aguda, lesión nodular heterogénea, presenta aumento de vascularización, aumento de ecogenicidad del tejido adyacente.
NECROSIS GRASA POST TRAUMATICA
Puede darse postraumática o postinyectable, el antecedente clínico es extremadamente relevante para reconocerla sobre todo en su presentación encapsulada.
Hallazgos ecográficos
Lesión hipoecoica ubicada en tejido subcutáneo, redondeada, mixta, no vasculariza al Doppler, presenta aumento de ecogenicidad adyacente y calcificaciones periférica, la presentación encapsulada es redonda, con calcificaciones y cursa sin alteración del tejido adyacente (imagen 10).
Imagen 10: Necrosis grasa en tejido subcutáneo con calcificación periférica y edema del adyacente. B) Necrosis grasa
Tabla 2: Tabla resúmenes con diagnósticos diferenciales más frecuentes de quistes epidérmicos.
Conclusión
Para diferenciar un quiste epidérmico de otras lesiones es necesario conocer las características ecográficas y presentación clínica de aquellas lesiones que presentan características similares. El conocimiento integral de cada patología orientará a realizar una adecuada representación y diagnóstico.
La ecografía es un examen útil y cada vez más necesario para apoyar al diagnóstico de patologías dermo-hipodérmica, la utilización de transductores de alta frecuencia, factores técnicos adecuadas y colchón de gel, son necesarios para orientar cada examen a un diagnóstico certero.
Existen diferencias ecográficas entre el quiste epidérmico y lesiones revisadas en este póster, por ejemplo el pilomatricoma presenta halo, vascularización y calcificaciones, o quiste triquilemal que no presenta punctum ni tampoco vasculariza al Doppler, entre otros casos. Reconocer las características ecográficas y clínicas de cada una de estas lesiones nos permitirá diferenciarlas correctamente.
Referencias
Imaging findings of rare plantar eccrine spiradenoma Author links open overlay panel Pankaj Nepal MD 1 , Syed Intakhab Alam MD 2. (s/f). Noheir Moustafa Taha MD,
Vázquez-Osorio, I., Gonzalvo-Rodríguez, P., & Rodríguez-Díaz, E. (2018). Actas Dermo-Sifiliograficas, 109(5), 453–455.
Won, K. Y., Park, S. Y., Jin, W., & Lew, B.-L. (2018). Dermatofibroma: sonographic findings and pathologic correlation. Acta Radiologica (Stockholm, Sweden: 1987), 59(4), 454–459.
1001 aspectos ecográficos del quiste de inclusión epidérmico Hospital Universitario Central de Asturias, Oviedo Hospital Universitario Marqués de Valdecilla, Santander
Daño Hepático Crónico: Hallazgos Ecográficos Importantes en Hepatopatía Crónica Parte II
TM Matías Ramirez - TM Elizabeth Vidal
Objetivo
La hepatopatía crónica en Chile ha ido aumentando significativamente debido a factores como el consumo excesivo de alcohol, las infecciones crónicas por el virus de la hepatitis y la creciente incidencia de enfermedades metabólicas como la obesidad y la diabetes. Debido a este gran aumento es que es importante revisar las características ecográficas del daño hepático crónico (revisadas en poster parte I) y sus complicaciones principalmente Hipertensión portal, ya que estas impactan severamente la calidad de vida de nuestros pacientes. Reconocer hallazgos específicos de hipertensión portal y sus complicaciones es fundamental para el seguimiento de pacientes con daño hepático crónico.
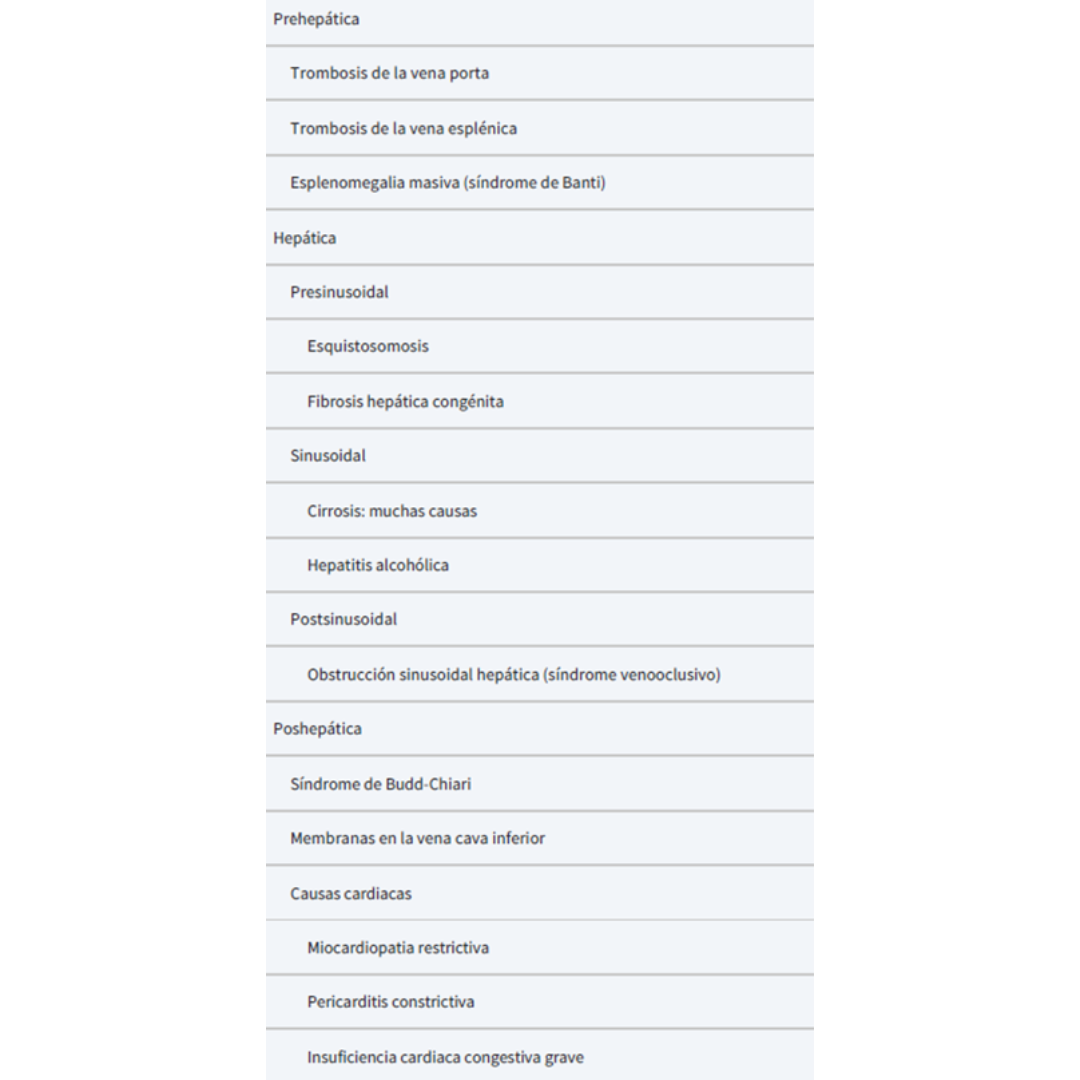
Clasificación Hipertensión Portal
Figura 1: Clasificación de HP según ubicación.
Hallazgos Ecográficos de Hipertensión Portal
Ascitis
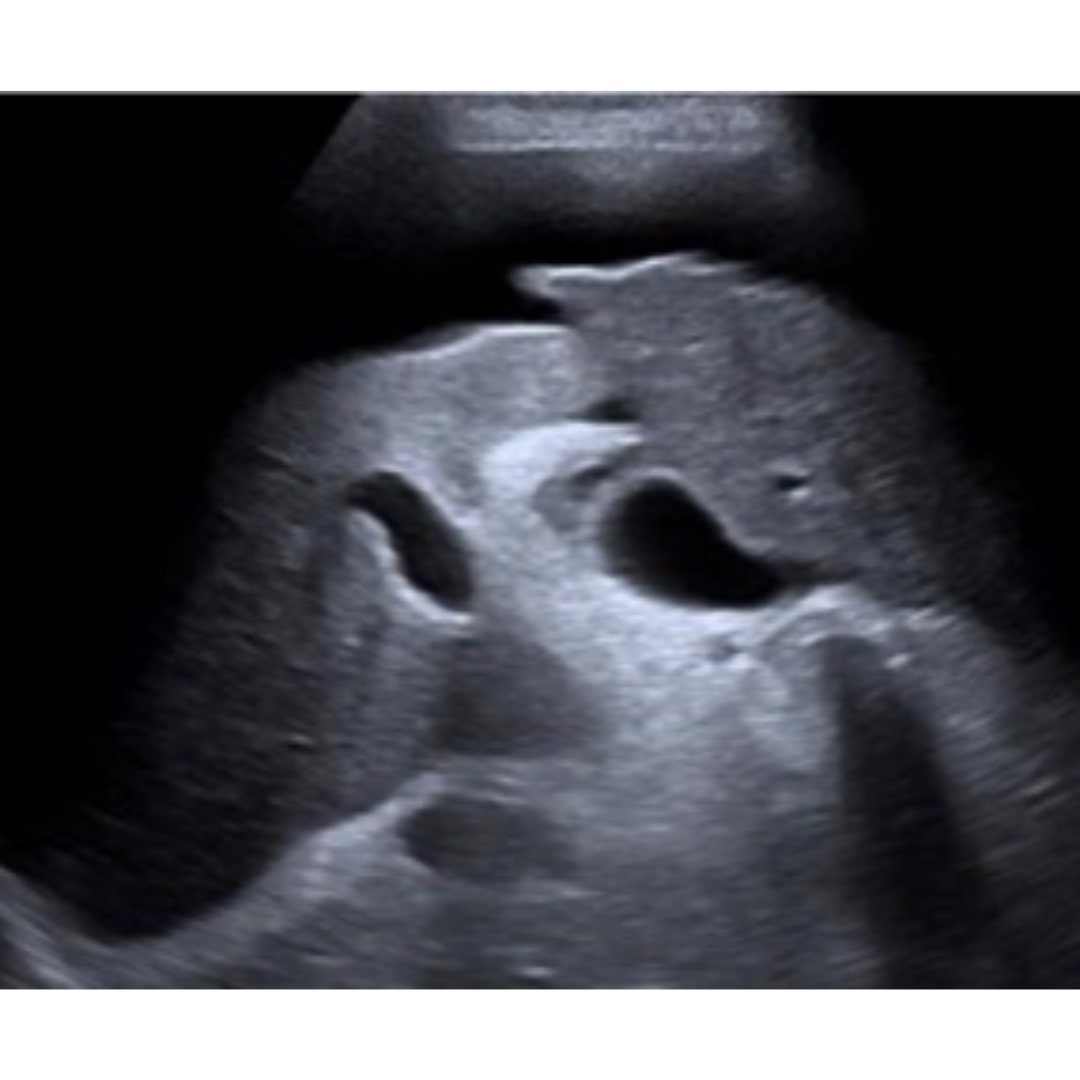
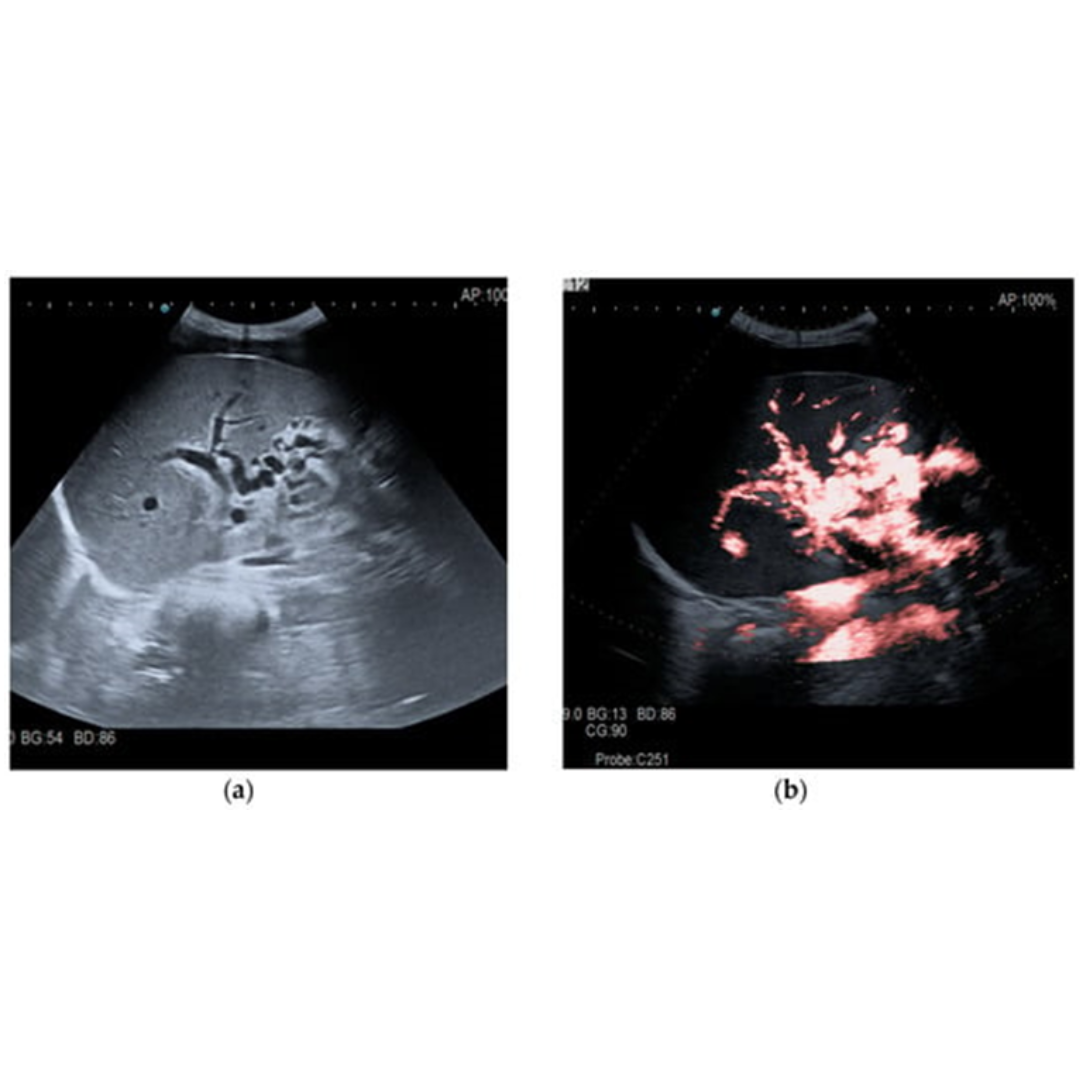
Es un signo inespecífico de hipertensión portal, su presencia es un signo de complicación de HP, sin embargo su ausencia no descarta HP. La ecografía es una técnica útil para descartar o confirmar su presencia, en las regiones donde frecuentemente se aloja es en el espacio de Morrison, peri hepático (figura 2), saco de Douglas, entre las asas intestinales, fosas iliacas etc.
Figura 2: Paciente con Cirrosis presenta liquido peri hepático
Esplenomegalia
Se define como esplenomegalia un diámetro del bazo superior a 13 cm, es un hallazgos altamente sensible pero con poca especificidad, ya que existen otras patologías que cursan con aumento de diámetro del bazo.
Diámetro de la Vena Porta
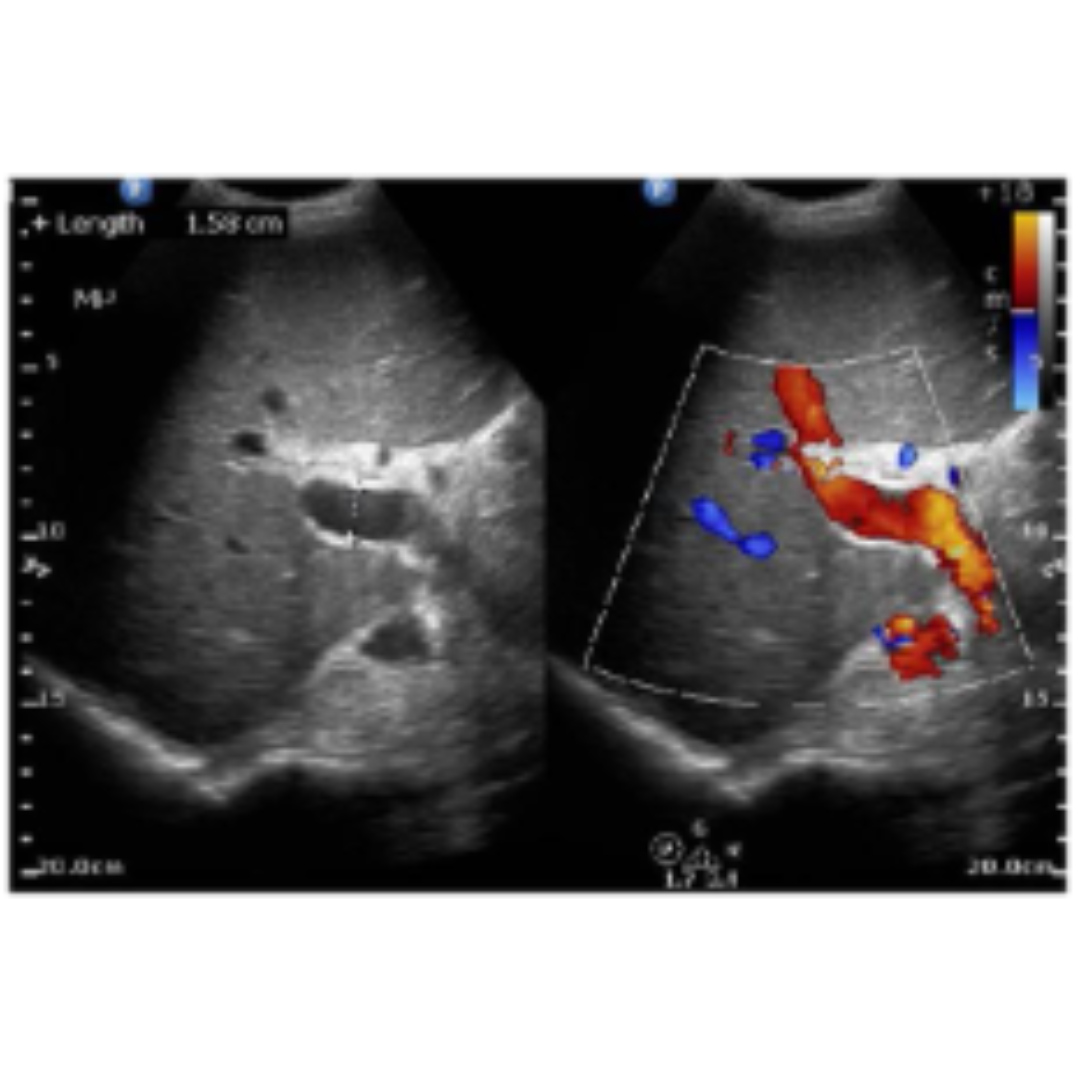
Se considera alterada partir de los 13 mm, la medición debe realizarse con el transductor en la región epigástrica o subxifoidea, con una leve inspiración para ver la vena porta posterior al lóbulo izquierdo. Si bien es un dato importante puede verse afectado por la posición del paciente, la respiración, el ayuno, otras causas como el flujo hepatofugo o la colateralidad portosistémica. Cuando esta se encuentre muy distendida es importante buscar posible trombosis asociada (figura 3 y 4).
Figura 3: Vena porta de tamaño aumento con diámetro de 18 mm.
Figura 4: Vena porta dilatada en su segmento extrahepático 2,5 cm con material hipoecogénico, compatible con trombosis que se prolonga craneal a la mesentérica superior
Disminución de la Velocidad Portal
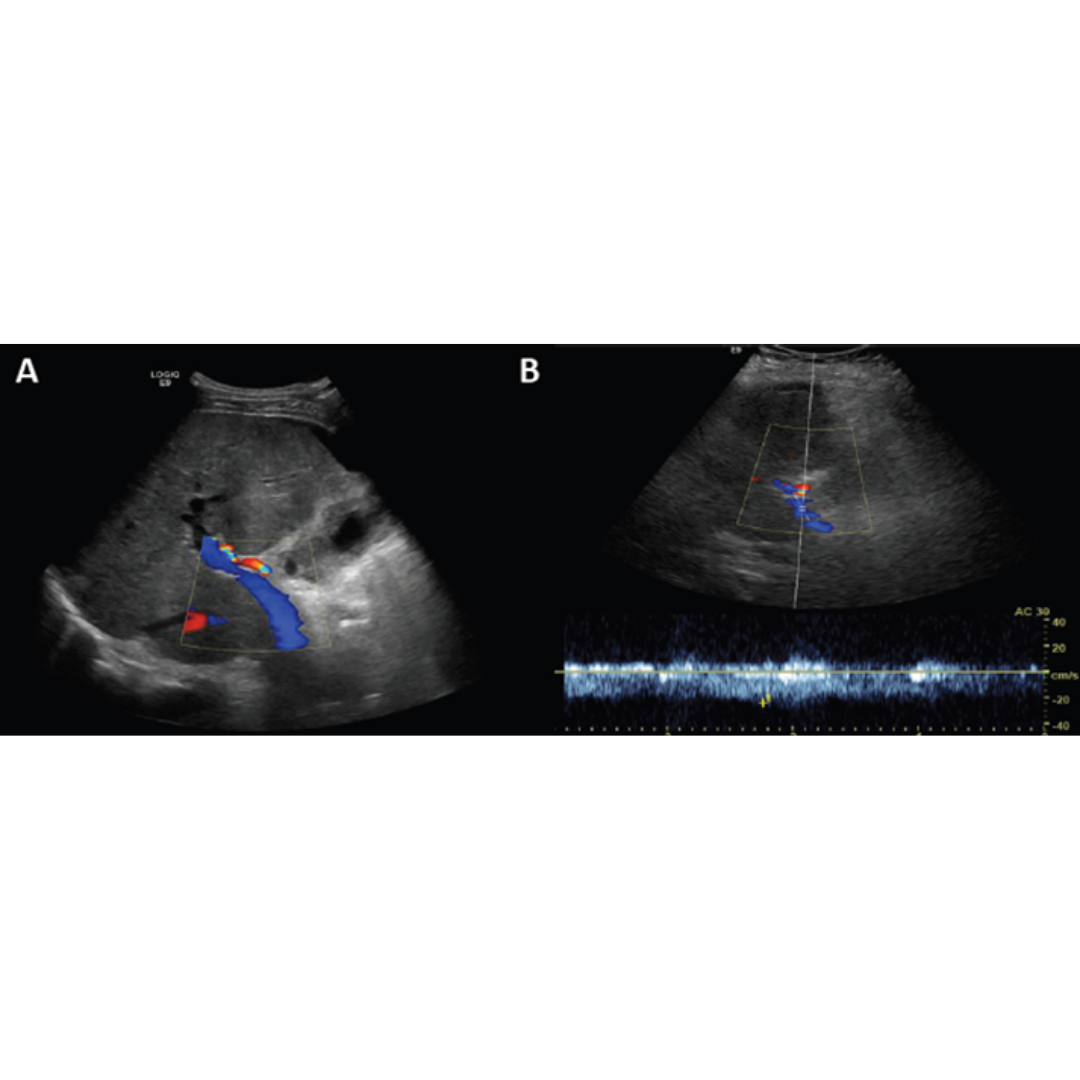
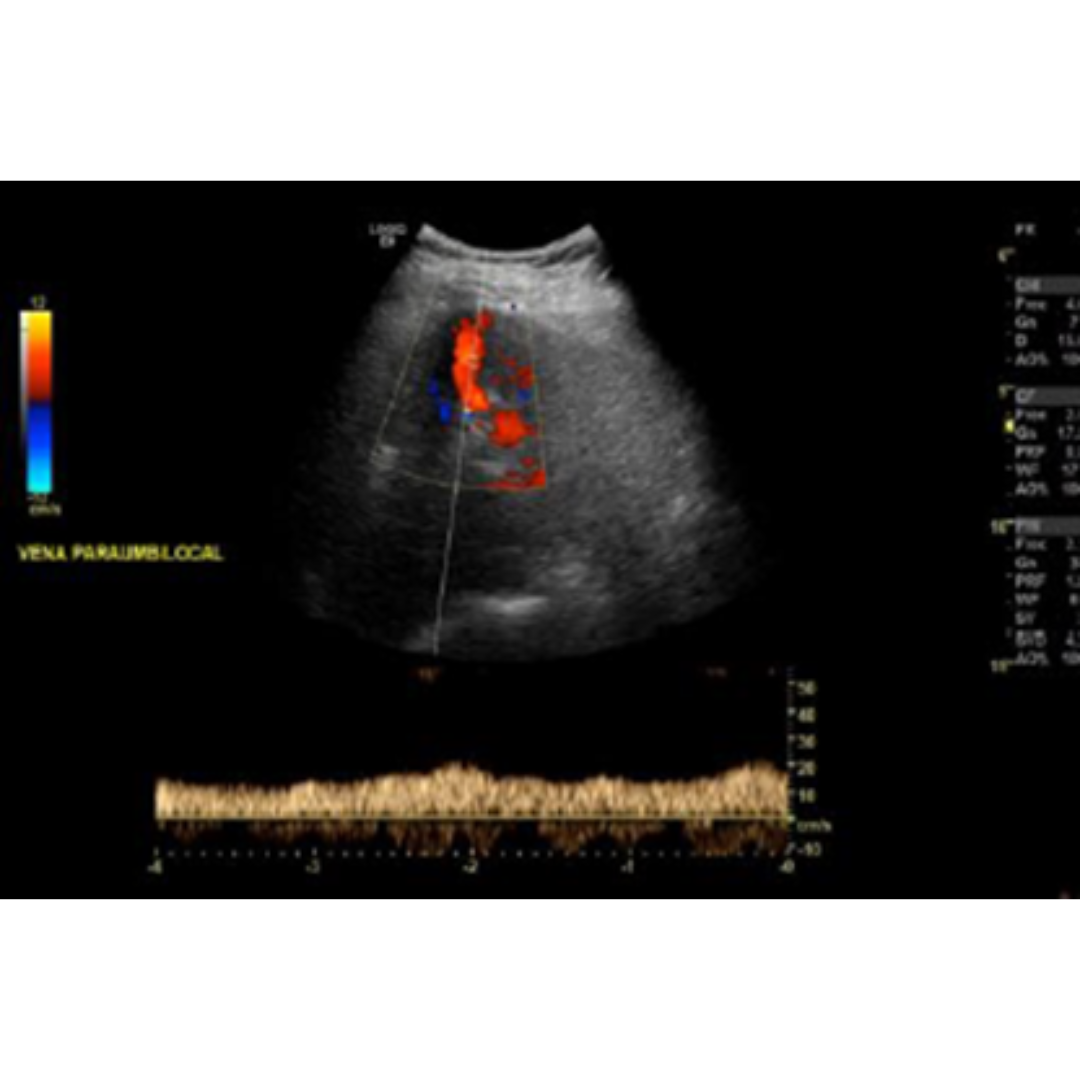
La velocidad portal normal es 15 a 18 cm/s, con el desarrollo de la HP la velocidad disminuye bajo 15 cm/s (figura 7). Las velocidades se verán alteradas por el tipo de colaterales que tenga el paciente. La velocidad media se puede ver aumentada solo en pacientes que presentan recanalización de la vena para umbilical (figura 5-6) y disminuida en pacientes con colaterales espleno-renales (2).
Figura 5-6: Vena porta con flujo hepatopeto, con un estudio espectral con velocidad encima de 25 cm/s, figura 5 paciente con recanalización de vena paraumbilical en paciente con HP severa.
Figura 7: Vena porta con flujo hepatopeto, con velocidad disminuida menor a 15 cm/s
Inversión del Flujo Portal
A través de un abordaje intercostal debemos interrogar el flujo portal, cuando el flujo se encuentra ingresando al hígado recibe el nombre de hepatopeto (hallazgo normal), por el contrario cuando el flujo se encuentra saliendo del hígado recibe el nombre de hepatofugo (patológico). En un flujo hepatofugo encontramos al Doppler color un flujo alejándose del transductor (figura 8), podemos usar de referencia la vena cava (siempre debe ser contrario a vena porta) y se debe caracterizar en color azul, al Doppler espectral el flujo portal se ubicará bajo la curva y se observará con pérdida de la fasicidad habitual dada por respiración y movimiento cardiaco. En algunos pacientes con cirrosis puede existir un vaivén entre estos 2 tipos de flujo.
Figura 8: Vena porta principal permeable con flujo hepatofugo con velocidad por debajo de la línea base.
Cambios en Venas y Arterias Hepáticas
En las venas intrahepáticas al estudio espectral se visualiza un cambio de su morfológica típica trifásica, existe un aplanamiento o incluso morfología pseudoportal viéndose un flujo de aspecto bifásico por consecuencia de la estenosis que generan los nódulos de regeneración (figura 9).
Figura 9: A. Aplanamiento de la onda de la vena hepática media con pérdida del flujo trifásico a flujo bifásico. Flujo trifásico normal de venas suprahepática.
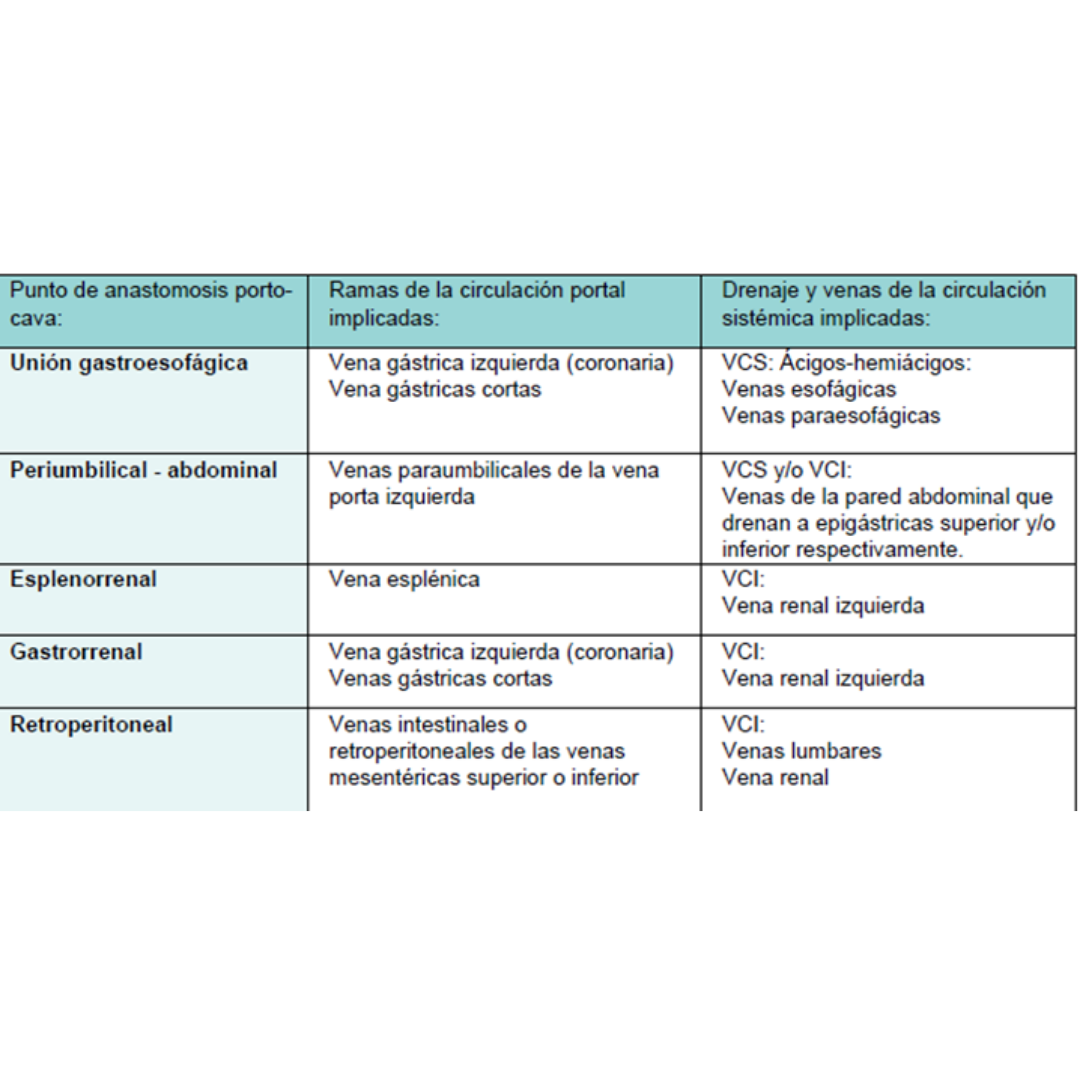
Colaterales Portosistémicas
Las colaterales portosistémicas son el signo más categórico de HP, se producen por un mecanismo complejo que implica apertura, dilatación e hipertrofia de canales vasculares preexistentes para descomprimir el sistema portal. Las anastomosis porto-cava ocurren en las localizaciones indicadas en la figura 10.
Figura 10 : Localizaciones comunes de anastomosis porto-cava
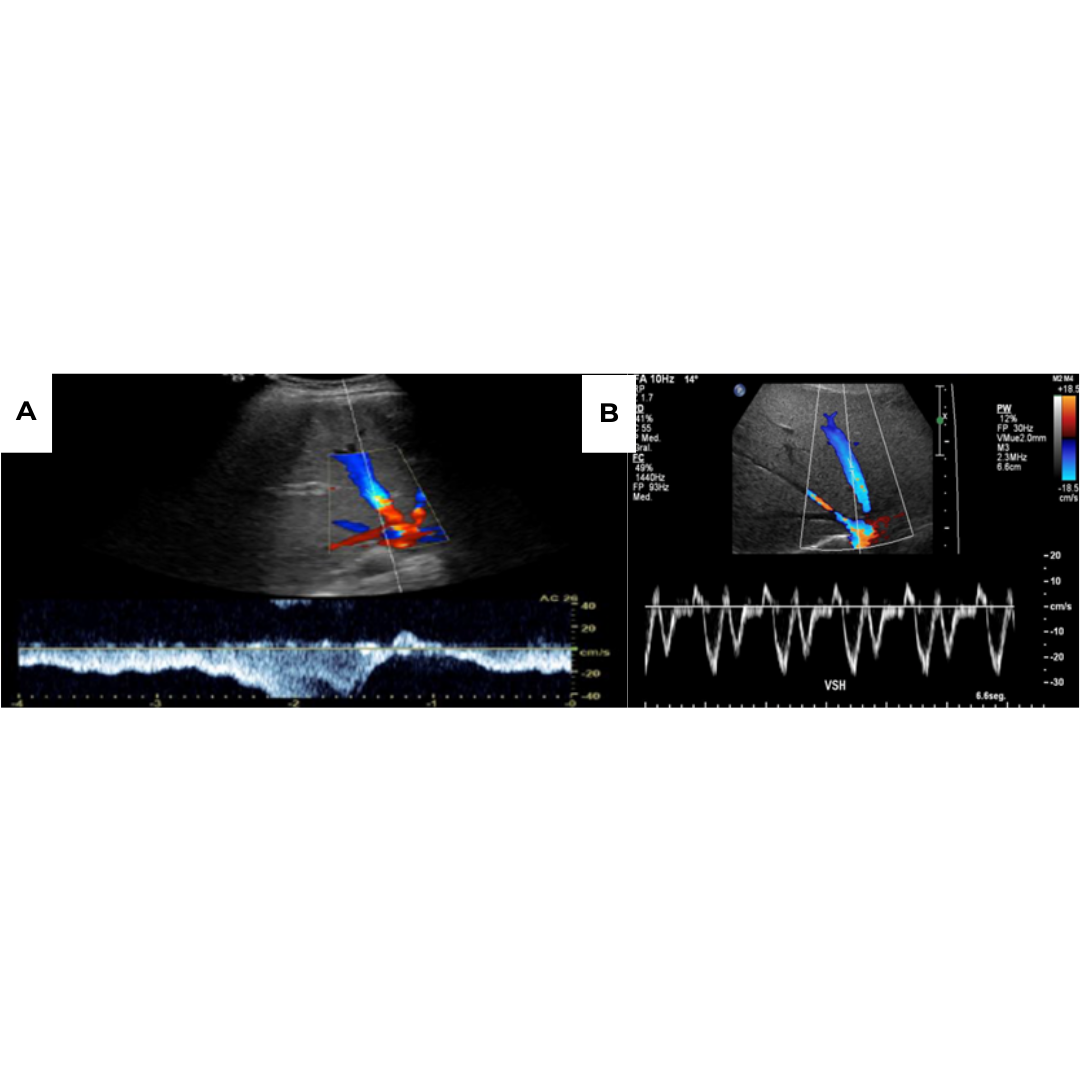
Figura 12: Permeabilización de vena para umbilical con flujo hepatofugo y pico de velocidad de hasta 20 cm/s. Estas venas con flujo hepatofugo alto evitan el desarrollo de varices esofágicas.
Figura 11: Unión gastroesofágica: ecográficamente se tiene que buscar una vena gástrica izquierda dilatada visible entre la pared anterior del estómago y la superficie posterior del lóbulo hepático izquierdo.
Estas varices tienen alto riesgo de generar hemorragia digestiva alta.
Figura 13: Varices de la pared abdominal, se tratan de venas subcutáneas dilatada que se extienden por la pared abdominal anterior, viéndose morfológicamente con el “signo de la medusa”. En la imagen se visualiza entramado vascular en epiplón mayor a la pared abdominal anterior. En corte sagital se visualiza derivación de la porta izquierda y se extiende al abdomen, teniendo correlación con la colateralidad para umbilical.(2)
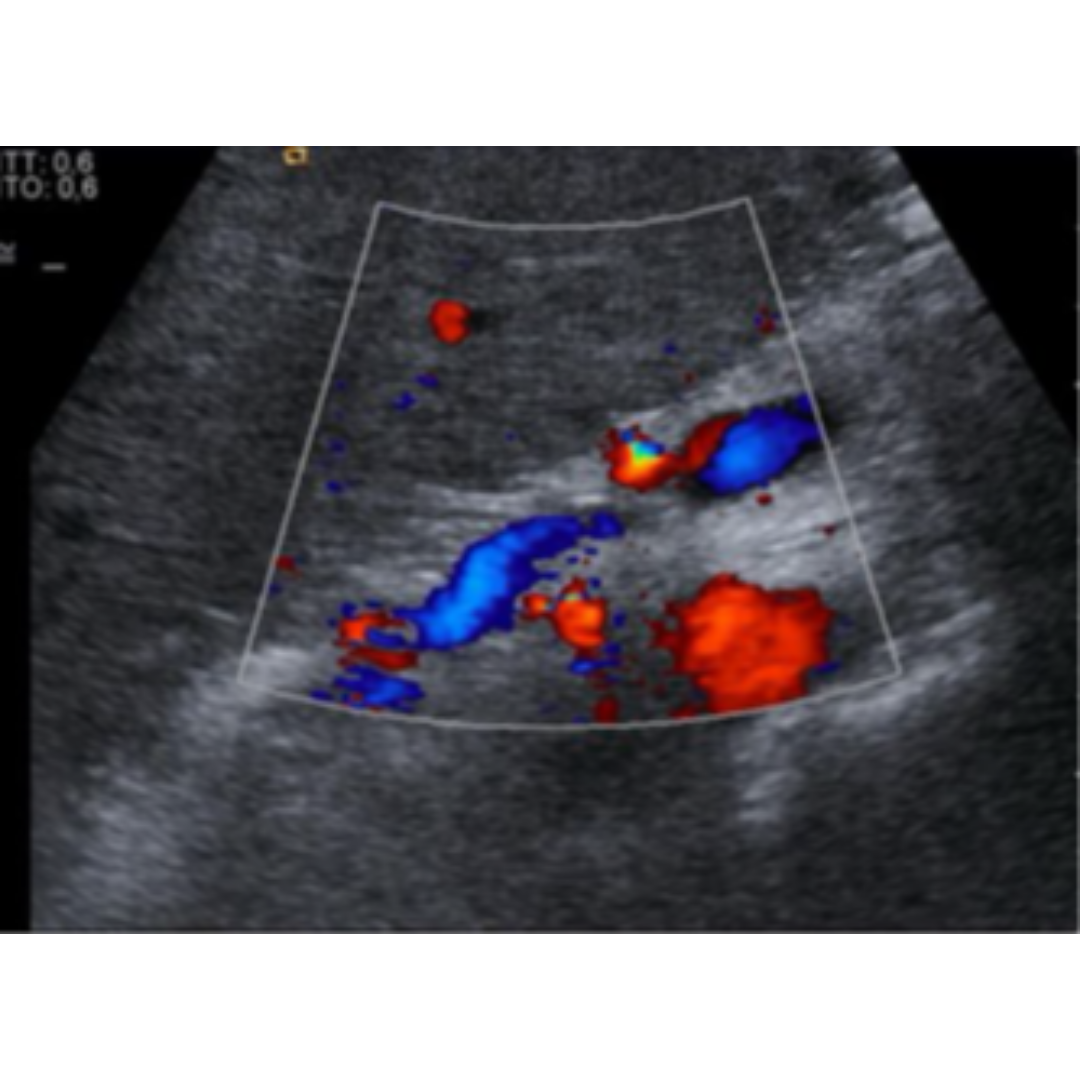
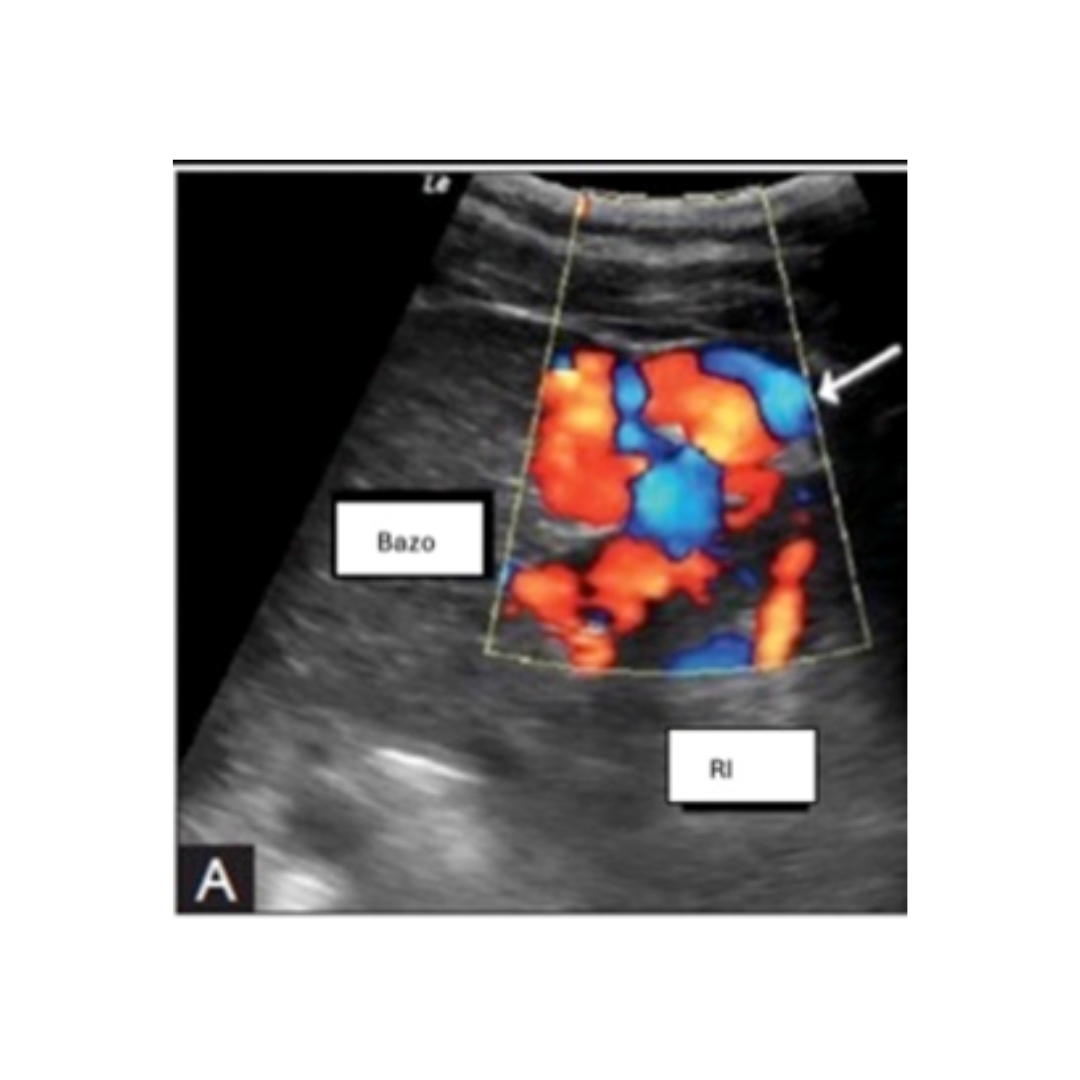
Shunt Espleno Renal
Ecográficamente se visualiza una gran cantidad de varices en hilio esplénico, sin visualización clara de la derivación.
Figura 14: Corte longitudinal ecografía con Doppler color, que demuestra la presencia de grandes y tortuosos (flecha) vasos entre el Riñón izquierdo (RI) y bazo, sugerente de shunt Espleno renal.
Síndrome Hepatorrenal (SHR)
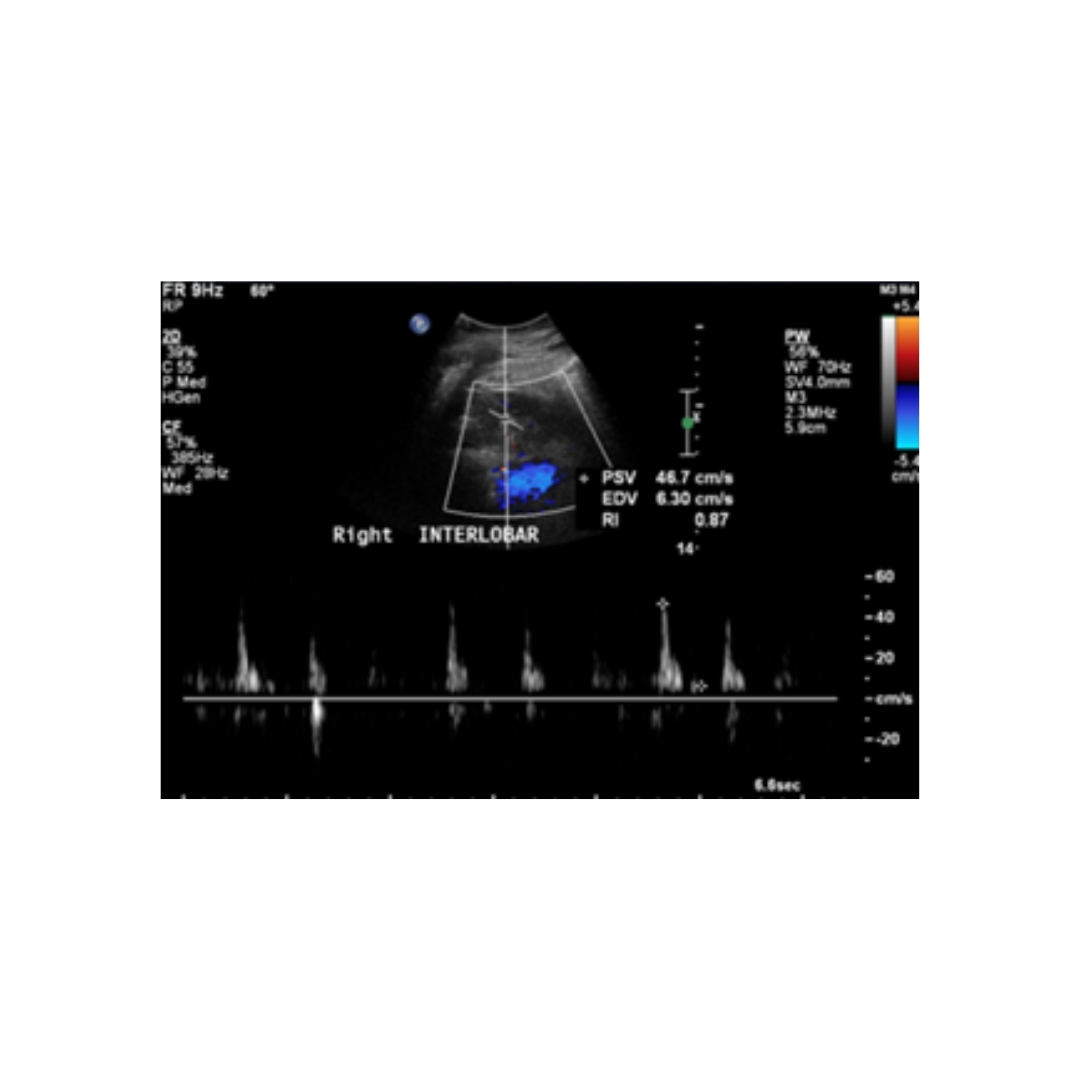
Este síndrome es una forma de insuficiencia renal funcional sin patología renal de base que ocurre aproximadamente en el 10% de los pacientes con cirrosis avanzada. Esta aparece como consecuencia de una intensa vasoconstricción de la circulación renal secundaria a la disfunción circulatoria sistémica. El diagnóstico del SHR requiere un valor de creatinina menor a 1,5 mg/dl con una Tasa de filtrado glomerular <30 ml/Min/1,73 m2.
A nivel ecográfico en modo B no observan alteraciones en el riñón, sin embargo en el estudio espectral esperamos ver índices de resistencia (IR) elevados por sobre 0.7 como consecuencia de la vasoconstricción (figura 15).
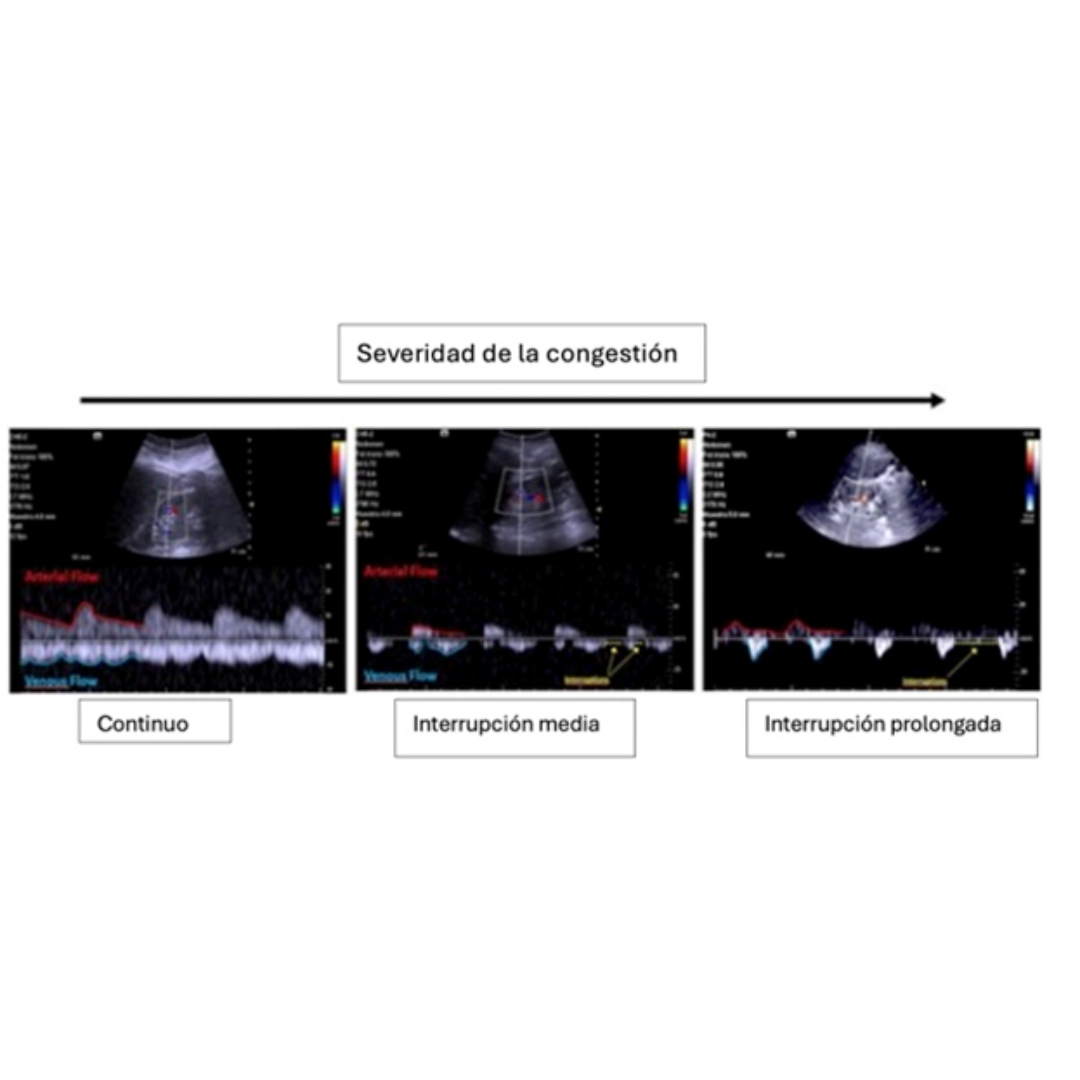
Figura 15: Ecografía renal de paciente con Cirrosis y SHR con IR elevado arteria interlobar derecha. (3)
Figura 16: Evaluación del flujo venoso renal en presencia de congestión. En condiciones normales el flujo es continuo y puede observarse por debajo, con una línea azul, A medida que hay mayor congestión sistémica se vuelve bifásico o monofásico. (4)
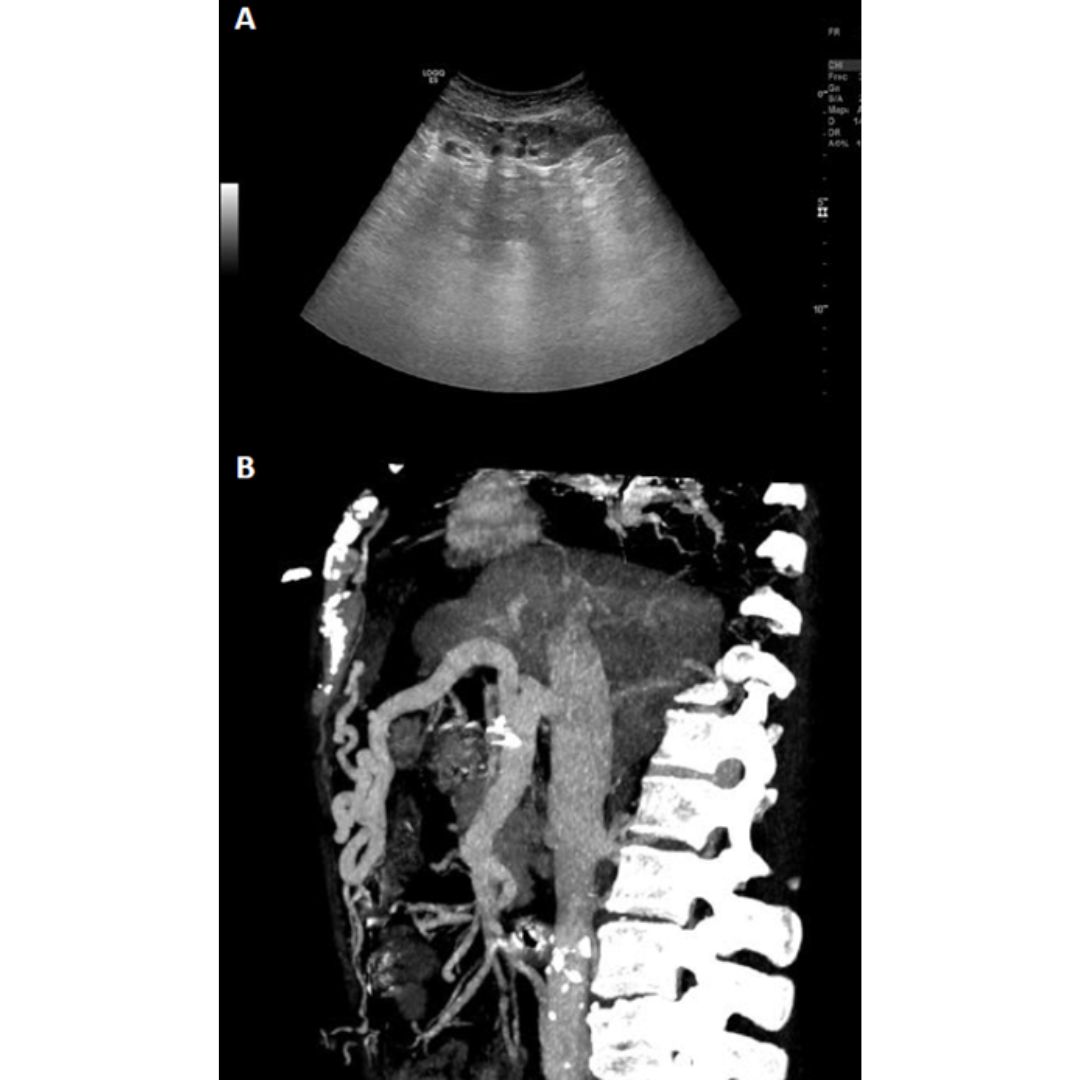
Cavernomatosis Portal
Es una enfermedad poco frecuente causada por trombosis en la vena porta que puede darse por invasión tumoral (hepatocarcinoma), por cirrosis avanzada donde el flujo hepático se ve severamente disminuido hasta trombosarse.
En estos casos se desarrolla una circulación colateral alrededor de una porta con calibre reducido y tromobosada, pudiéndose ver a nivel intra como extrahepático (figura 17 y 18 ).
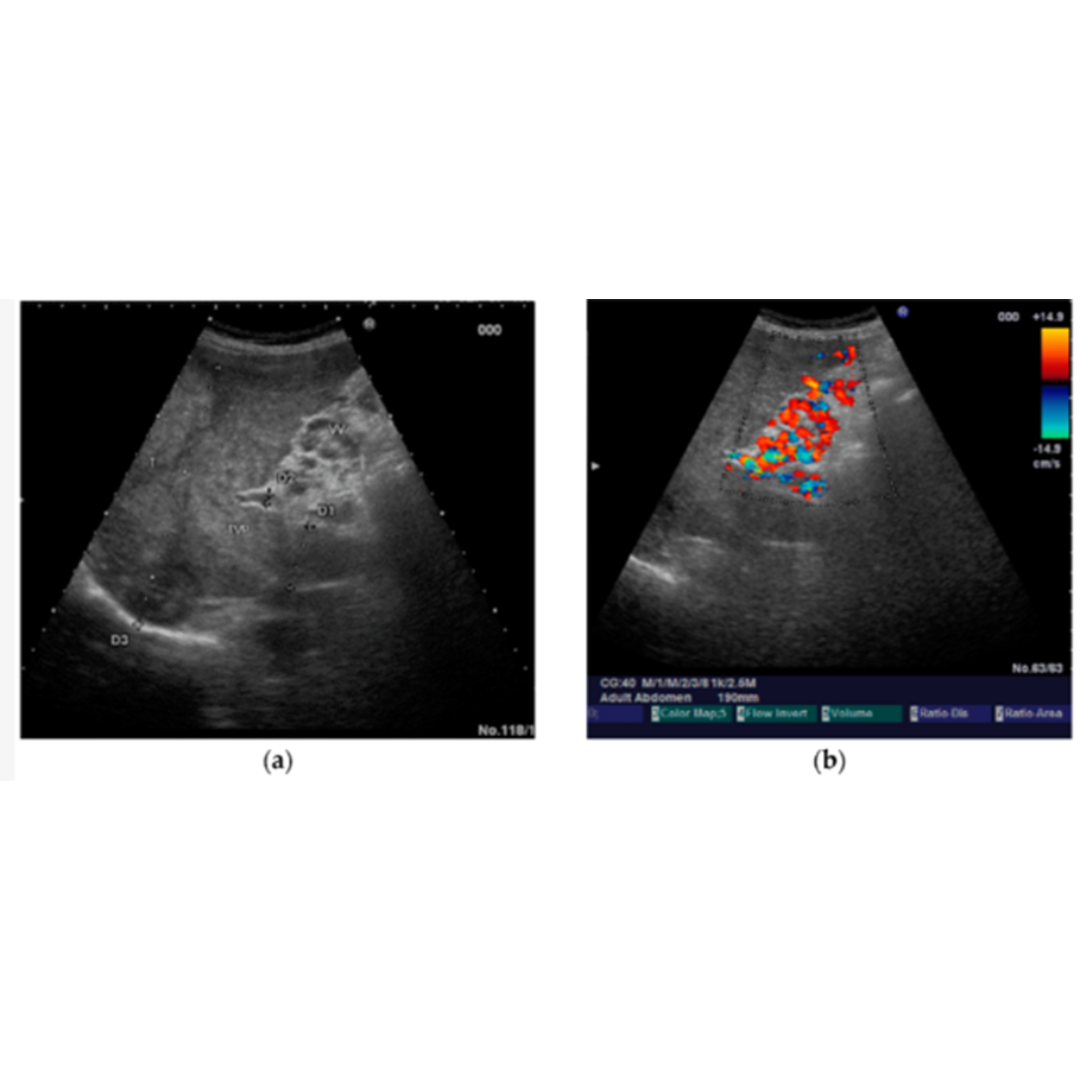
Figura 17: Transformación portal cavernosa, se observan en modo B múltiples vasos serpiginosas libres de eco que reemplazan a la vena porta en hilio hepático, viéndose presencia de flujo venoso dentro de los cavernosas. (5)
Figura 18: Ramas venosas sinuosas en hilio hepático, con porta trombosada. Doppler color identifica flujo dentro de los vasos.
Encefalopatía Hepática
La encefalopatía portosistémica es una complicación grave de la hepatopatía crónica y se define en términos generales como una alteración en estado mental y cognitivo. Las neurotoxinas derivadas del intestino que no son eliminadas en hígado llegan al encéfalo generando los síntomas. Es típico observar incremento de las concentraciones de amoniaco, aunque no es un valor indicativo de la enfermedad, además se puede generar edema cerebral.
Conclusión
La encefalopatía portosistémica es una complicación grave de la hepatopatía crónica y se define en términos generales como una alteración en estado mental y cognitivo. Las neurotoxinas derivadas del intestino que no son eliminadas en hígado llegan al encéfalo generando los síntomas. Es típico observar incremento de las concentraciones de amoniaco, aunque no es un valor indicativo de la enfermedad, además se puede generar edema cerebral.
Referencias
Gómez, S. D. L., Castellano, S. E. R., & Balbuena, S. M. C. (2022, 26 mayo). Revisión de los hallazgos por imagen de la hipertensión portal. https://piper.espacio-seram.com/index.php/seram/article/view/8959
Gilabert, R., & Nicolau, C. (2003). Ecografía Doppler color en el diagnóstico de la hipertensión portal. Gastroenterología y Hepatología Continuada, 2(5), 216-220. https://www.elsevier.es/es-revista-gastroenterologia-hepatologia-continuada-8-pdf-70000139
Mogawer, M. S., Nassef, S. A. R., Elhamid, S. M. A., Elkholy, S., Aziz, N. E. A. E., Al-Jarhi, U. M., & Abdellatif, A. A. (2021b). Role of renal Duplex ultrasonography in evaluation of hepatorenal syndrome. Egyptian Liver Journal, 11(1). https://doi.org/10.1186/s43066-021-00104-9
Banegas-Deras, E. J., Mazón-Ruiz, J., Romero-González, G., Ruiz-Cobo, J. C., Sanz-García, C., Serrano-Soto, M., Sánchez, E., & Argaiz, E. R. (2024). Acute Kidney Injury and Point-of-Care Ultrasound in Liver Cirrhosis: Redefining Hepatorenal Syndrome. Clinical Kidney Journal, 17(5). https://doi.org/10.1093/ckj/sfae112
Cazacu, S. M., Alexandru, D. O., Dumitrescu, D., Vieru, A. M., Urhuț, M. C., & Săndulescu, L. D. (2024). Prevalence and Risk Factors for Portal Cavernoma in Adult Patients with Portal Vein Thrombosis. Diagnostics, 14(13), 1445. https://doi.org/10.3390/diagnostics14131445
Daño Hepático Crónico: Hallazgos Ecográficos Importantes en Hepatopatía Crónica Parte I
TM Rebeca Candia - TM Elizabeth Vidal
Objetivo
El Daño Hepático Crónico (DHC) es un problema de salud mundial. Chile no se encuentra exento de esta problemática de salud, por lo que no es infrecuente encontrarnos con una ecografía abdominal donde el paciente padezca DHC; en ocasiones podremos encontrarnos con casos más avanzados y otros de reciente comienzo, por lo que es sumamente importante reconocer todos los hallazgos ecográficos que nos permitan apoyar al diagnóstico o realizar un seguimiento acucioso de la enfermedad. A continuación revisaremos hallazgos ecográficos del DHC.
Revisión del tema
El DHC es una injuria prolongada del hígado, que provoca fibrosis y distorsión de arquitectura por la formación de nódulos. Consta de etapas progresivas que conllevan a una insuficiencia compensada o descompensada.
Causas de DHC
DHC alcohólico
Esteatohepatitis no alcohólica
Hepatitis crónica
Enfermedad colestásica crónica
Enfermedad metabólica
Figura 1: Signos y síntomas del DHC.
Hallazgos ecográficos del DHC
I) Superficie Irregular Nódulos fibróticos de regeneración
Cuando sospechamos de un DHC es recomendable estudiar el hígado con transductor lineal, para demostrar y estudiar la presencia de nódulos en el parénquima. En casos incipientes, el uso de transductor lineal será fundamental para demostrar las lobulaciones de la cápsula hepática. La superficie hepática se observa heterogénea debido a la presencia de nódulos que pueden tener las siguientes presentaciones:
Patrón macronodular, mayor a 1 cm.
Patrón micronodular, hasta 1 cm.
Hepatocarcinoma: La presencia de una lesión macronodular, de 1 a 2 cm, deben hacernos sospechar de un nódulo neoplásico y requerirá estudios adicionales.
El rol de la ecografía en pacientes con diagnostico en DHC es :
Principalmente pesquisar la presencia de nódulos sospechosos, donde la ecogenicidad no será de ayuda, ya que existe un porcentaje menor de hepatocarcinomas que cursan hiperecogénicos por lo que tendrán ecogenicidad variable. La vascularización también ayudará a diferenciar los nódulos sospechosos de hepatocarcinoma de un nódulo de regeneración, ya que estos últimos no vascularizan al Doppler a diferencia de un hepatocarcinoma que si presentan señal al Doppler.
Además también es labor de la ecografía evidenciar las complicaciones del DHC, evaluar signos del hipertensión portal, valorar la presencia de ascitis, esplenomegalia, etc.
Figura 2: Las imágenes muestran irregularidad de superficie, ascitis y los patrones nodulares.
Figura 3: A.- Dilatación de la porta y ascitis. B.- Esplenomegalia. C.- Lóbulo hepático izquierdo con bordes irregulares. D.- hipertrofia del lóbulo
II) Aumento de Volumen Hepático
Dentro de los hallazgos ecográficos podemos encontrar perdida de los ángulos hepáticos y la redistribución de volumen donde podremos encontrar:
Aumento de tamaño del lóbulo caudado ( > 3.5 o 4 cm)
Hepatomegalia
Atrofia del Lóbulo hepático derecho, principalmente segmento IV.
Figura 4: Medidas para referenciar aumento de volumen hepático
III) Cambios en la Ecogenicidad
Por infiltración grasa
Aumento de ecogenicidad por fibrosis
Ecoestructura heterogénea
Figura 5: Aumento de ecogenicidad del parénquima hepático.
Complicaciones DHC
El daño hepático es actualmente la causa más frecuente de hipertensión portal, en un DHC con hipertensión portal podremos encontrar diferentes hallazgos como:
Esplenomegalia y aparición de vasos colaterales.
Hipertensión portal (diámetro AP > 13 mm)
Velocidad de vena porta ≤ 16 cm/sg
Y en la medida que avanzan las complicaciones pueden presentarse:
Ascitis
Peritonitis bacteriana espontanea (PBE)
Encefalopatía hepática
Hemorragias variciales
Síndrome hepatorenal
Síndrome hepatopulmonar
Carcinoma hepatocelular
Figura 6: Aumento del diámetro de la porta.
Conclusión
La ecografía tiene un rol fundamental en el seguimiento de DHC, pero también en el diagnostico de la enfermedad, reconocer los signos ecográficos el DHC será útil para pesquisar incluso aquellos casos que no presentan un DHC avanzados.
Un ecografista entrenado podrá hacer un correcto seguimiento de la enferrmedad realizando un estudio acabado del hígado, lóbulo por lóbulo buscando la presencia de nódulos que pudiesen progresar a Hepatocarcinoma. Además de reconocer los signos de hipertensión portal que es la complicación mas frecuente de DHC.
Referencias
Egea Medel, N., Paraira Beser, M., Juanico Termes, I., Alejandro Gonzalez Tejada, J., Rosa Martí Domenech, M., & Pedrerol Perez, A. (2018). Hallazgos ecográficos en la cirrosis e hipertensión portal. Seram
REV ESP ENFERM DIG (Madrid). Vol. 103, N.° 5, pp. 227-231, 2011. Utilidad de la ultrasonografía en el diagnóstico de las enfermedades hepáticas difusas
De Franchesci Clara Ma, A., Andrea, R. M., Marta, M. H., Silvia, C. C., David, C. R., Isabel, Á. M. M., Iván, C. A., Enrique, M. B., De Franchesci Clara Ma, A., Andrea, R. M., Marta, M. H., Silvia, C. C., David, C. R., Isabel, Á. M. M., Iván, C. A., & Enrique, M. B. (s. f.). Hepatomegalia, polifagia e hipertransaminasemia. https://scielo.isciii.es/scielo.php?script=sci_arttext&pid=S1139-76322021000100016
Grau, A. S., López, I. V., Rodríguez, N. D., & Cabral, J. S. (2014). Ecografía hepática: lesiones focales y enfermedades difusas. Medicina de Familia SEMERGEN, 42(5), 307-314. https://doi.org/10.1016/j.semerg.2014.10.012
Quiste de Inclusión Epidérmico y sus Características Ecográficas
TM Daniela Fuenzalida - TM Elizabeth Vidal
Objetivo
Durante los últimos años el rol de la ecografía en el estudio de bultomas palpables se ha vuelto considerablemente más relevante, siendo la lesión más frecuente entre estos los quistes de inclusión epidérmica, donde la ecografía presenta una elevada sensibilidad y especificidad. Es por este motivo que revisaremos las características ecográficas típicas y atípicas de los quistes de inclusión, porque una ecografía en manos de un ecografista especializado permite que el diagnostico de un quiste de inclusión no requiera estudios de imagen adicionales.
Revisión del tema
El quiste de inclusión epidérmico se presenta en el cuero cabelludo, cara, cuello y espalda. Son más frecuentes en hombres que mujeres, en la tercera y cuarta década de vida.
Es una lesión intraepitelial que se origina en la dermis por proliferación e implantación de elementos epidérmicos. Se pueden observar como una tumoración redondeada de crecimiento progresivo y consistencia firme. Los quistes pueden tener características atípicas, ecoestructura variable, y cursar procesos inflamatorios.
Figura 1: Frecuente abertura central de comedón oscura (punctum) que indica la conexión entre la superficie del quiste y el revestimiento del quiste.
Figura 2: Imagen quística con contenido ecogénico, heterogéneo, circunscrita, y ovalada.
Figura 3: Estratificación ecográfica
Etiopatogenia
Pueden ser de inclusión espontánea o adquiridas de epitelio escamoso queratinizado en dermis o hipodermis.
Tabla 1: Etiopatogenia
Características ecográficas
Se encuentran descritas en la tabla 2.
Tabla 2
Figura 4: Representación morfológica.
Figura 5: Recápsula como una fina línea hiperecogénica.
Figura 6: Ecoestructura: hipoecogénicos, heterogéneos. Con presencia de hendiduras lineales hipoecogénicas, líneas hiperecogénica y punto ecogénicos, ejemplos de patrón seudotesticular (A, C, F) y patrón capas de cebolla (B,D,E).
Figura 7: Relación con tejidos adyacentes: refuerzo acústico es una constante y es frecuente que se asocie a sombras laterales. Los quistes complicados no alteran la ecoestructura adyacente.
Figura 8-9: Vascularización: son Avasculares, es frecuente el artefacto de centelleo por su contenido y múltiples interfases. En quistes complicados veremos vascularización periférica.
Elastografía
Los quistes no complicados se comportan como lesiones firmes ya que presentan poca elasticidad dado a su contenido rico en queratina, siendo estos de mayor dureza que los complicados. Tienen un comportamiento opuesto a gangliones y quistes sinoviales.
Figura 10: Revisión breve elastrografía Strain
Complicaciones de los quistes de inclusión
1) Quiste de inclusión con degeneración maligna
Se asocian a quistes de inclusión epidérmica gigantes mayores a 5 cm, clínicamente son similares a un quiste infectado. La degeneración maligna de un quiste de inclusión es extremadamente rara, generalmente hacia carcinoma de células escamosas y menos frecuente a carcinoma basocelular.
Estos se observan con las mismas características ecográficas mencionadas anteriormente, pero varia en la presencia de hendiduras anecogénicas filiformes dentro del patrón pseudotesticular. Estas hendiduras se distribuyen aleatoriamente o hacia la periferia con láminas hiperecogénicas en su interior.
Figura 11: Quiste de inclusión epidérmica gigantes.
2) Rotura de quistes de Inclusión epidérmica
Los pacientes que presentan rotura de un quiste de inclusión presentan clínicamente eritema, hinchazón, sensibilidad en la palpación y dolor en la zona del bultoma.
Bajo ecografía se observa los hallazgos descritos en tabla 3.
Tabla 3: Hallazgos ecográficos del quiste epidérmico roto.
Figura 12: Quiste de inclusión epidérmica gigantes.
Figura 13: Quiste de inclusión en eminencia tenar que ha aumentado de tamaño bruscamente y es doloroso: A) área de rotura (doble flecha azul), B) Quiste verdadero con cápsula y márgenes discretamente lobulados por pérdida.
3) Quiste de inclusión epidérmico Infectado
La causa más frecuente de inflamación de un quiste es la rotura, resultando frecuente que los quistes de inclusión se inflamen, pero no que se infecten. Los quistes severamente inflamados pueden infectarse y es importante saber que un quiste infectado cambia la conducta clínica, requiriendo incisión y drenaje con antibioterapia, siendo el tratamiento definitivo la exéresis posterior a la resolución del cuadro agudo.
Tabla 4: Rotura/infección
Es importante saber que un quiste roto no siempre va a cursar con gran compromiso de rotura, pero un quiste infectado si tendrá signos de rotura.
Figura 14: Quiste de inclusión infectado confirmado. A) y B) eje largo y corto: engrosamiento y disminución de ecogenicidad de dermis suprayacente y aumento de ecogenicidad del TCS, perdida de definición capsular y de tensión del quiste con are fluctuante central, C) y D) aumento muy significativo de vascularización de tejidos adyacentes y cápsula.
Conclusión
La ecografía es la técnica de elección en estudio de tumores superficiales y sobre todo el quiste de inclusión. Es importante conocer los diferentes hallazgos presentes en un quiste epidérmico asintomático y sintomáticos que pueden encontrarse infectados. Es relevante diferenciar un quiste roto de uno infectado, siendo está diferenciación importante para el médico tratante, además independiente de lo poco frecuente debemos conocer aquellos hallazgos que indican degeneración de un quiste epidérmico, siendo el objetivo de cualquier ecografista lograr disminuir drásticamente la palabra “indeterminado” y aportar a un diagnóstico certero.
Referencias
Park JS, Chae IS, Kwom DR. Utility of Sonoelastography in Differentiating Ruptured From Unruptured Epidermal Cysts and Implications for Patient Care. J Ultrasound Med 2015; 34:1175–1181
X. Wortsman. Diagnóstico por imagen en dermatología. Técnicas de diagnóstico por imagen ecográfica en dermatología.2018 Elsevier España.
Viveros Vargas, D. R. D., Herrán De La Gala, D. D., Barba Arce, D. A. B., Lamagrande Obregón, D. A., Landeras Álvaro, D. R. M., Martínez Camblor, D. L., & Agromayor Elena Carmen, D. E. C. (2022). 1001 aspectos ecográficos del quiste de inclusión epidérmico. Seram, 1(1). Recuperado a partir de https://piper.espacio-seram.com/index.php/seram/article/view/9636
Dolor Agudo en FID: Los Diagnósticos Diferenciales que el Ecografista debe conocer
TM Natalia marín - TM elizabeth vidal
Objetivo
Entre las causas del dolor agudo en la fosa ilíaca derecha (FID) se incluye un gran abanico de patologías que cursan un cuadro clínico muy similar, por lo que el objetivo es realizar una revisión de los signos ecográficos de aquellas afectaciones que se presentan con dolor en FID, y aprender a diferenciarlos, para lograr llegar a un diagnóstico y tratamiento oportuno.
Revisión del tema
En la FID se pueden desarrollar diversas patologías agudas, lo que la convierte en un punto de interés para diferenciar cada una de ellas y llegar a un diagnóstico y manejo adecuado. Entre las causas más comunes de dolor se encuentra la apendicitis aguda, afecciones ginecológicas, así como también patologías intestinales.
Apendicitis Aguda
Inflamación del apéndice cecal producida por obstrucción de su lumen, ya sea por fecalitos, tejido linfoide hiperplásico, parásitos o tumores.
Presenta varios estadios evolutivos: congestiva, flegmonosa, necrótica y perforada.
Signos US: aumento del diámetro del apéndice cecal (> 6 mm) y pared apendicular engrosada (> 3 mm), signo del fondo de saco ciego, apéndice no compresible, grasa peri apendicular hiperecogénica, la señal al Doppler color dependerá del estadio evolutivo (en fase aguda existirá hiperemia), puede existir apendicolito asociado.
Figura 1: Apéndice cecal aumentado de tamaño, con hiperemia y grasa periapendicular hiperecogénica. En B y C se observa el signo del fondo de saco ciego característico de afectación apendicular.
Ileitis Aguda
Es la inflamación del íleon, frecuentemente a nivel de su porción terminal.
Signos US: pared intestinal engrosada (> 3 mm) y no compresible, capa submucosa engrosada e hiperecogénica, aumento de la ecogenicidad de la grasa adyacente, hiperemia parietal, disminución del peristaltismo, adenitis mesentérica(*).
(*) La adenitis mesentérica es una expresión frente a una inflamación intestinal, por lo que sus signos ecográficos van a acompañar siempre a una ileitis.
Figura 2: Pared intestinal engrosada e hiperemia.
Adenitis Mesentérica
Es la inflamación de ganglios linfáticos del mesenterio, es considerado un signo en respuesta a inflamación y no un diagnóstico.
Signos US: aumento de tamaño de varios ganglios linfáticos (AP > 7 mm) presentes en FID y/o mesogastrio, con aumento de vascularización hiliar al Doppler color.
Figura 3: Múltiples ganglios aumentados de tamaño, se observa incremento de su vascularización hiliar.
Invaginación o Intususcepción Intestinal
Es el deslizamiento de una porción intestinal dentro de otra. Generalmente se presenta a nivel de la unión ileocecal en niños. En adultos es muy poco frecuente y se relaciona con la presencia de una lesión tumoral (benigna o maligna), puede ser tanto a nivel del intestino delgado, como del colon.
Signos US: en corte longitudinal se observará el “signo del sándwich” y en transversal el “signo de la diana”, aumento de la ecogenicidad de la grasa adyacente, la presencia de señal al Doppler color indicará si aún existe tejido viable, de lo contrario ya hay isquemia/necrosis.
Figura 4: En (a) el signo del sándwich en un corte longitudinal y en (b) el signo de la diana en sentido transversal.
Patología Intestinal Crónica: Enfermedad de Crohn
Patología inflamatoria intestinal de carácter crónico y autoinmune, puede afectar tanto al intestino delgado como al grueso, siendo su ubicación más frecuente entre el íleon terminal y el colon. Tiende a afectar todas las capas, perdiendo la estratificación de capas bajo ultrasonido.
Signos US: Engrosamiento de la capa submucosa, lesiones segmentarias (tramos de intestino afectado se intercalarán con tramos sanos), hiperemia de la pared intestinal, grasa adyacente hiperecogénica, pérdida del peristaltismo, ganglios mesentéricos reactivos. En algunos casos se observa signo de “pseudoriñón” cuando la afectación es transmural.
Figura 5: Hiperemia y engrosamiento parietal irregular sin pérdida de la estratificación intestinal.
Figura 6: Engrosamiento Transmural, se observa signo de pseudoriñón, que indica pérdida de la estratificación intestinal.
Torsión Ovárica
Causada por anexos muy móviles o frente a la presencia de un quiste o masa anexial preexistente que ejerza peso.
Signos US: Aumento de volumen y tamaño ovárico unilateral (> 4 cm) con folículos desplazados hacia la periferia, estroma ovárico heterogéneo e hiperecogénico, rotación del pedículo ovárico que se evidencia con el “signo del remolino”, presencia de líquido libre en el saco de Douglas.
Figura 7: En (A) se ve ovario aumentado de tamaño con folículos desplazados hacia la periferia, y en (B) el signo del remolino.
Embarazo Ectópico
Implantación del óvulo fecundado fuera de la cavidad uterina, siendo la localización tubárica la más frecuente.
Signos US: saco gestacional fuera del útero con embrión en su interior, masa heterogénea tubárica (signo del anillo tubárico), la cual será hipervascular (signo del anillo de fuego).
Figura 8 6tf: (A) masa anexial con el signo del anillo tubárico, y (B) signo del anillo de fuego frente al Doppler color.
Conclusión
Si bien la ecografía no es el examen predilecto para estudiar la patología aguda, es una herramienta accesible y efectiva con la que, realizada con una adecuada correlación entre el cuadro clínico y elevada experiencia del profesional ecografista, será posible caracterizar correctamente la patología en algunos casos como adenitis mesentérica, ileitis, incluso evitará la realización de exámenes complementarios y la realización de procedimientos innecesarios.
Referencias
Capristo CE, Cassino MP, Sisu Di Pizio MF. Signo del anillo tubario. Rev Argent Radiol / Argent J Radiol [Internet]. 2017. Disponible en: http://www.scielo.org.ar/scielo.php?script=sci_arttext&pid=S1852-99922017000100011
Gaillard F, Sharma R, Gupta A, et al. Enfermedad de Crohn. Artículo de referencia, Radiopaedia.org. Disponible en: https://doi.org/10.53347/rID-6791
Garrote NES. Enfermedad inflamatoria crónica intestinal [Internet]. Uchile.cl. Disponible en: https://sintesis.med.uchile.cl/condiciones-clinicas/gastroenterologia/gastroenterologia-situaciones-clinicas/10898-enfermedad-inflamatoria-cronica-intestinal
Las distintas caras de la apendicitis aguda [Internet]. Espacio-seram.com. Disponible en: https://www.piper.espacio-seram.com/index.php/seram/article/view/8888/7354
Pacheco Rojas DA, Valls Masot DL, Bonfill Garcín DM, Pedraza Gutiérrez DS. Patología ovárica urgente: ¿Torsión o no torsión? Ésa es la cuestión. seram [Internet]. 18 de mayo de 2021. Disponible en: https://piper.espacio-seram.com/index.php/seram/article/view/4603
PATOLOGÍA AGUDA DE LA FOSA ILIACA DERECHA, MAS ALLÁ DE LA APENDICITIS [Internet]. Espacio-seram.com. Disponible en: https://piper.espacio-seram.com/index.php/seram/article/view/8067/6533
Silva H. Jorge; Jurado D. Mireya; Avalos G. Carmen. Invaginación intestinal en adultos: Espectro de imágenes y causas frecuentes [Internet]. Webcir.org. Disponible en: https://www.webcir.org/revistavirtual/articulos/2018/1_marzo/ec/invagiInvaginacion_esp.pdf
Hidradenitis Supurativa : Revisión de los hallazgos ecográficos y sus clasificaciones
TM Paz Acosta - TM Elizabeth Vidal
Objetivo
La Hidradenitis supurativa (HS) es una enfermedad inflamatoria crónica y muchas veces de difícil manejo. La inspección visual es limitada y el aporte de los exámenes de imágenes, principalmente del Ultrasonido, es apoyar el diagnóstico para determinar el grado de actividad inflamatoria y evaluar la extensión de la enfermedad. El objetivo de este póster es revisar aquellos hallazgos ecográficos que son relevantes reconocer bajo ecografía y clasificar el estadio de la HS.
Revisión del tema
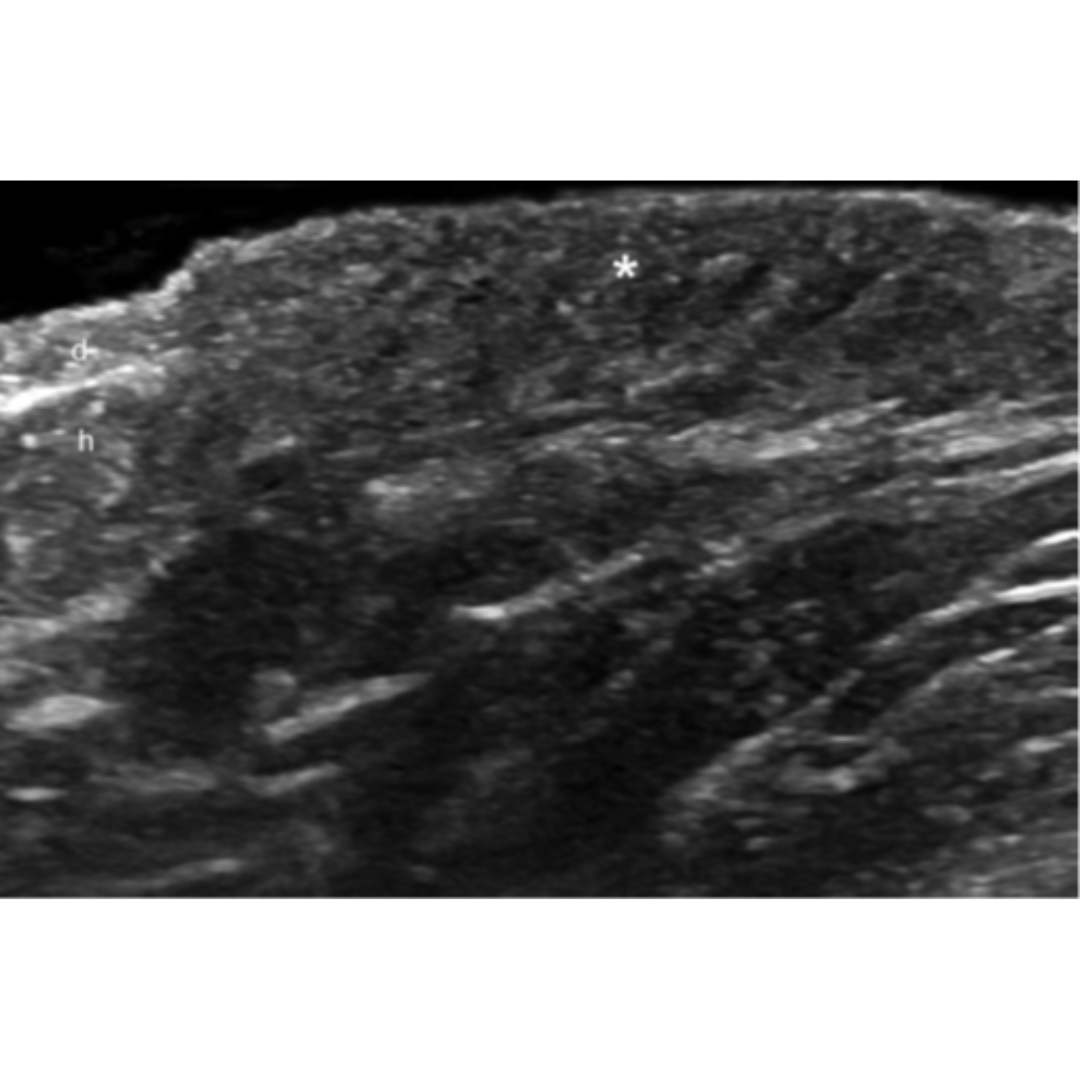
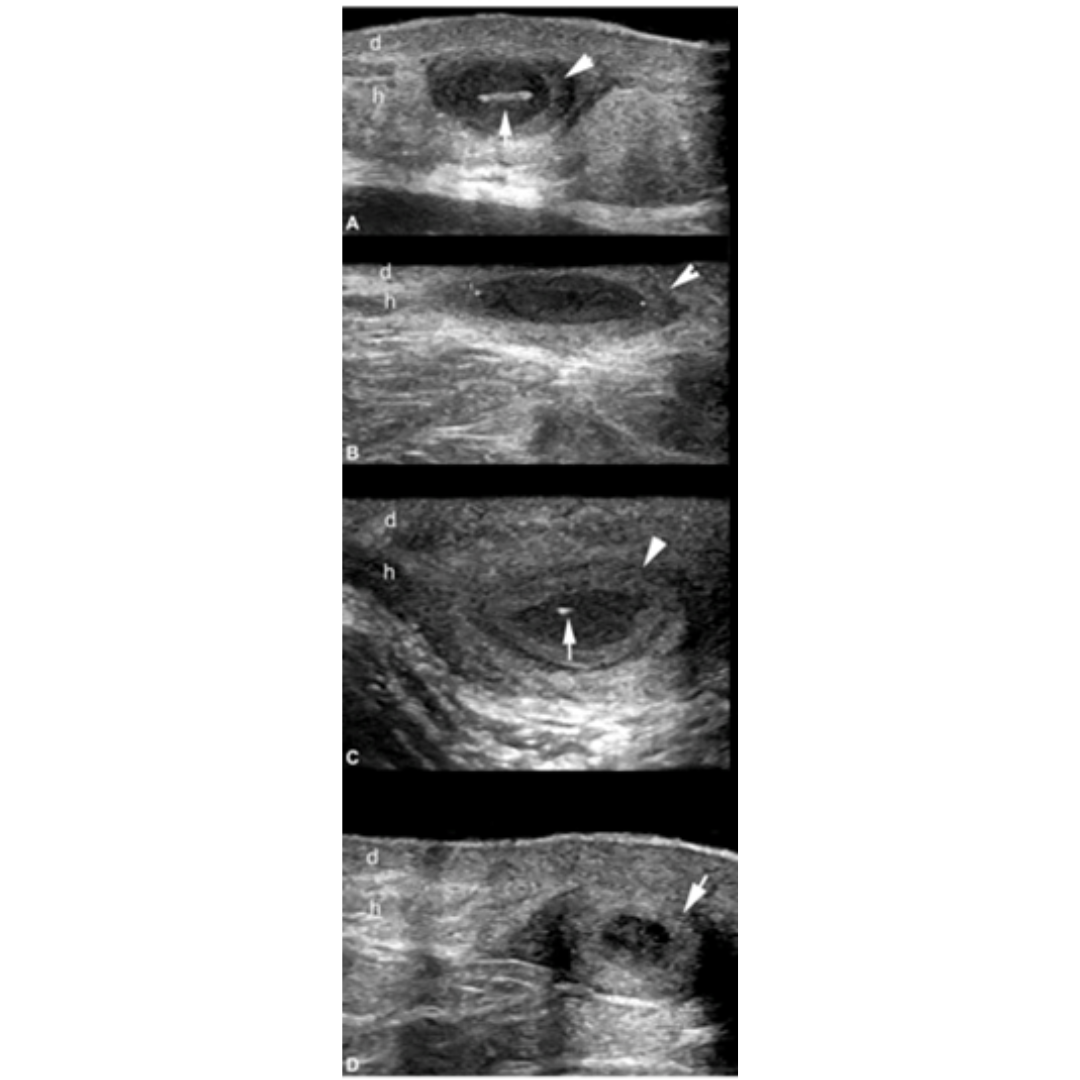
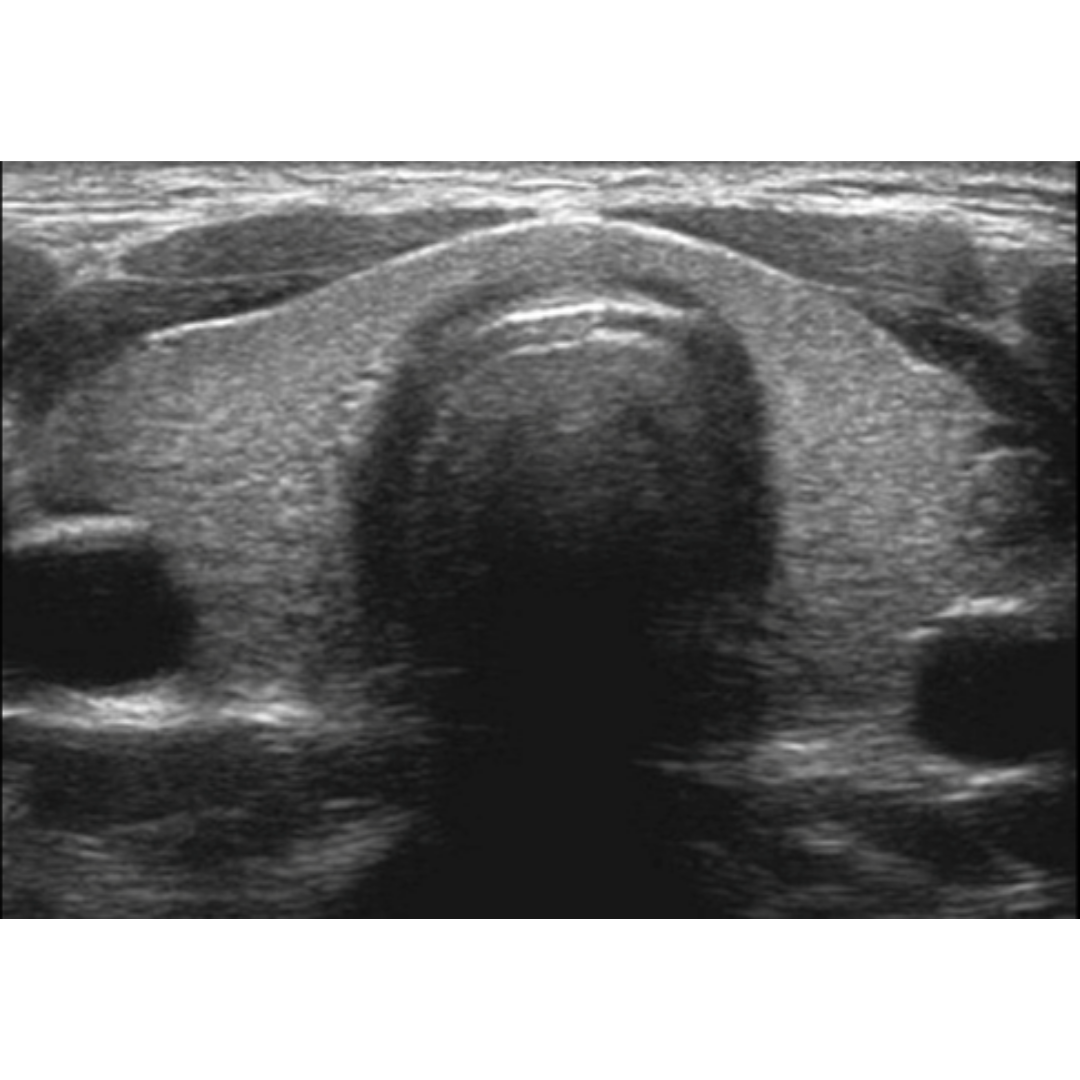
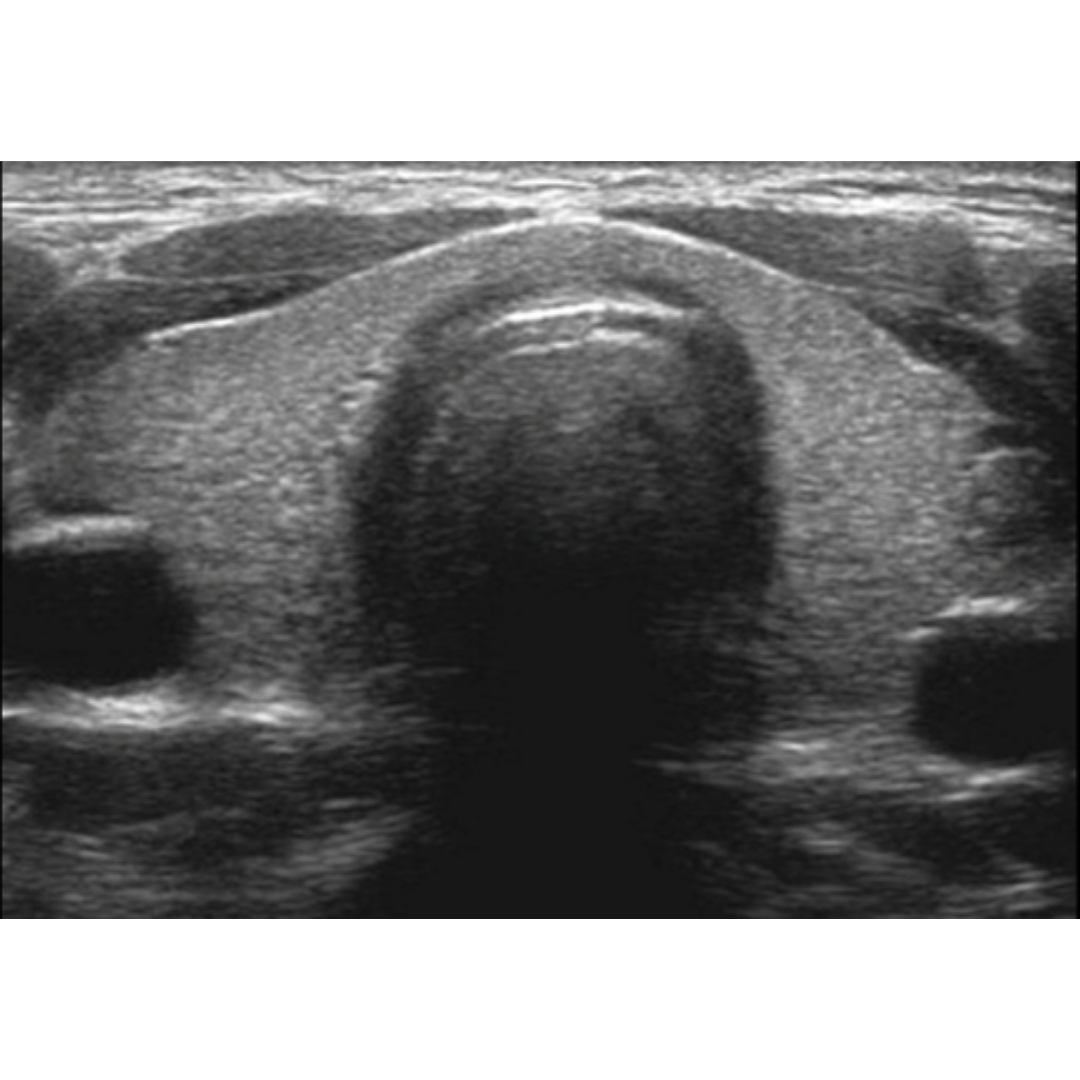
Figura 1: Imagen de ecografía de la región axilar que muestra el ensanchamiento de la parte superior de los folículos pilosos. (Signo de botella de Champagne)
Figura 2: Cambios dérmicos de la Hidradenitis Supurativa.
(*) Engrosamiento e hipoecogenicidad de la dermis
Piel normal: d: dermis h: hipodermis
La HS es una enfermedad que se caracteriza por la aparición de lesiones inflamatorias dolorosas y profundas en áreas corporales donde existen glándulas apocrinas como axilas, región inguinal, y región anogenital. Su prevalencia es de 2 a 5 veces mayor en el sexo femenino, con mayor frecuencia en el rango etario de 20 a 40 años. La HS es considerada una enfermedad de etiología multifactorial y recientemente se ha apoyado el origen de esta enfermedad en el folículo piloso, siendo considerada una enfermedad de oclusión folicular.
El rol de la ecografía en HS es fundamental para apoyar el diagnostico, realizar estadiaje y definir el grado de actividad inflamatoria.
Aporte de la Ecografía
La Ecografía se destaca por ser un examen que aporta imágenes de alta resolución para estructuras más superficiales del cuerpo y capas más profundas.
Permite medir las estructuras en centímetros en su eje largo en el caso de la HS para medir los trayectos fistulosos.
Es necesaria la obtención de imágenes con transductores de alta frecuencia.
El uso de la herramienta Doppler color o Power, aporta en la obtención de información en relación con la vascularización de la lesión y vascularización perilesional.
Visualización de tractos pilosos
Los tractos pilosos se observan como imágenes lineales hiperecogénicas dentro de la colección liquida.
La presencia de componentes de queratina no reabsorbibles en el cuerpo se observa como cuerpo extraño dentro de la HS.
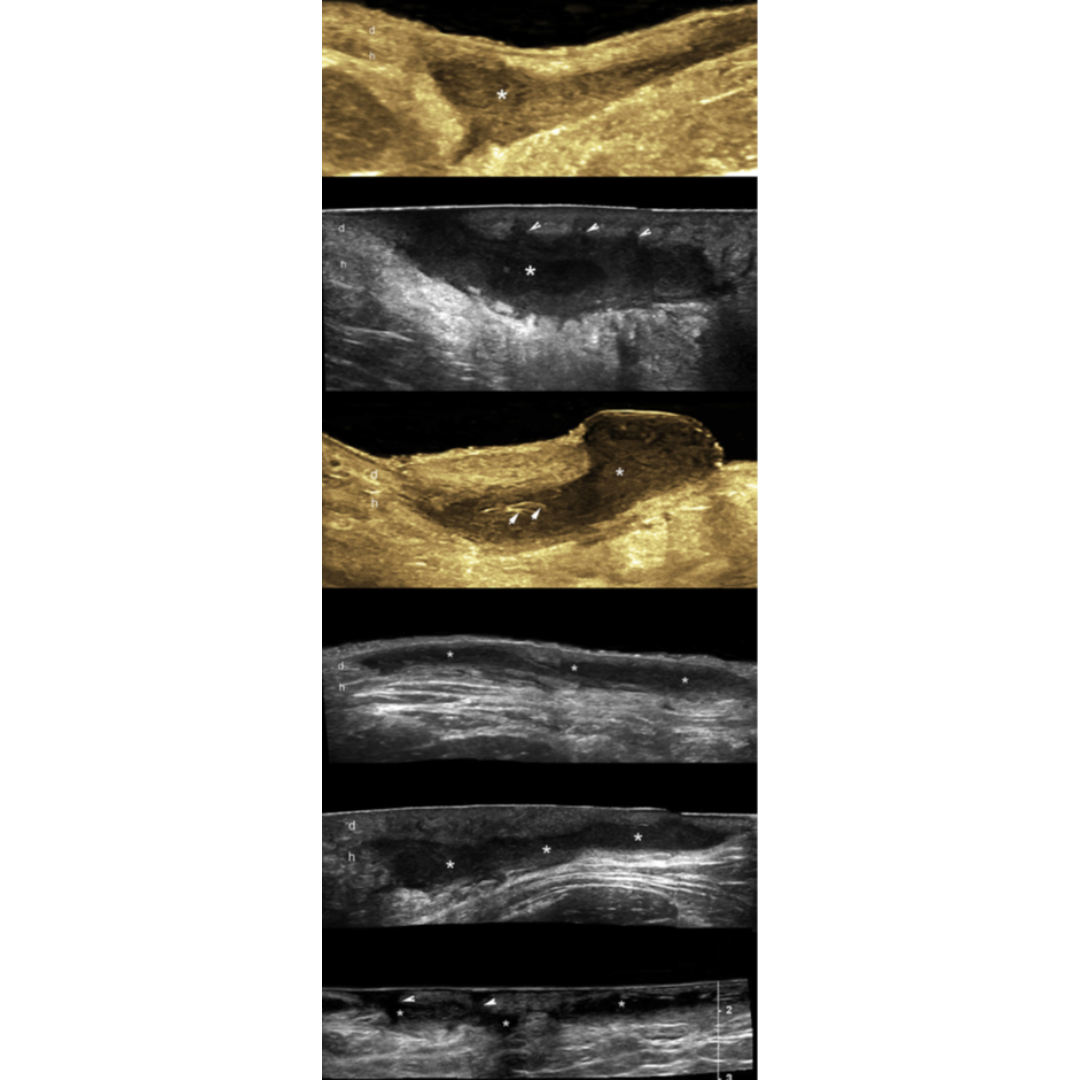
Figura 3: Imágenes de ecografía con apariencia variable de fistula. Se observan conexión de las fistulas con la parte inferior de los folículos pilosos dilatados y los fragmentos lineales hiperecogénicos de tractos pilosos dentro de la fistula.
Figura 4: Hidradenitis supurativa de presentación variable, colecciones de líquido dérmico e hipodérmico. El asterisco señala las colecciones y las puntas de flecha apuntando hacia arriba indican los fragmentos lineales hiperecogénicos de los tractos pilosos dentro de la colección. Las flechas apuntando hacia abajo indican las conexiones entre las colecciones de líquido con los folículos pilosos dérmicos ensanchados.
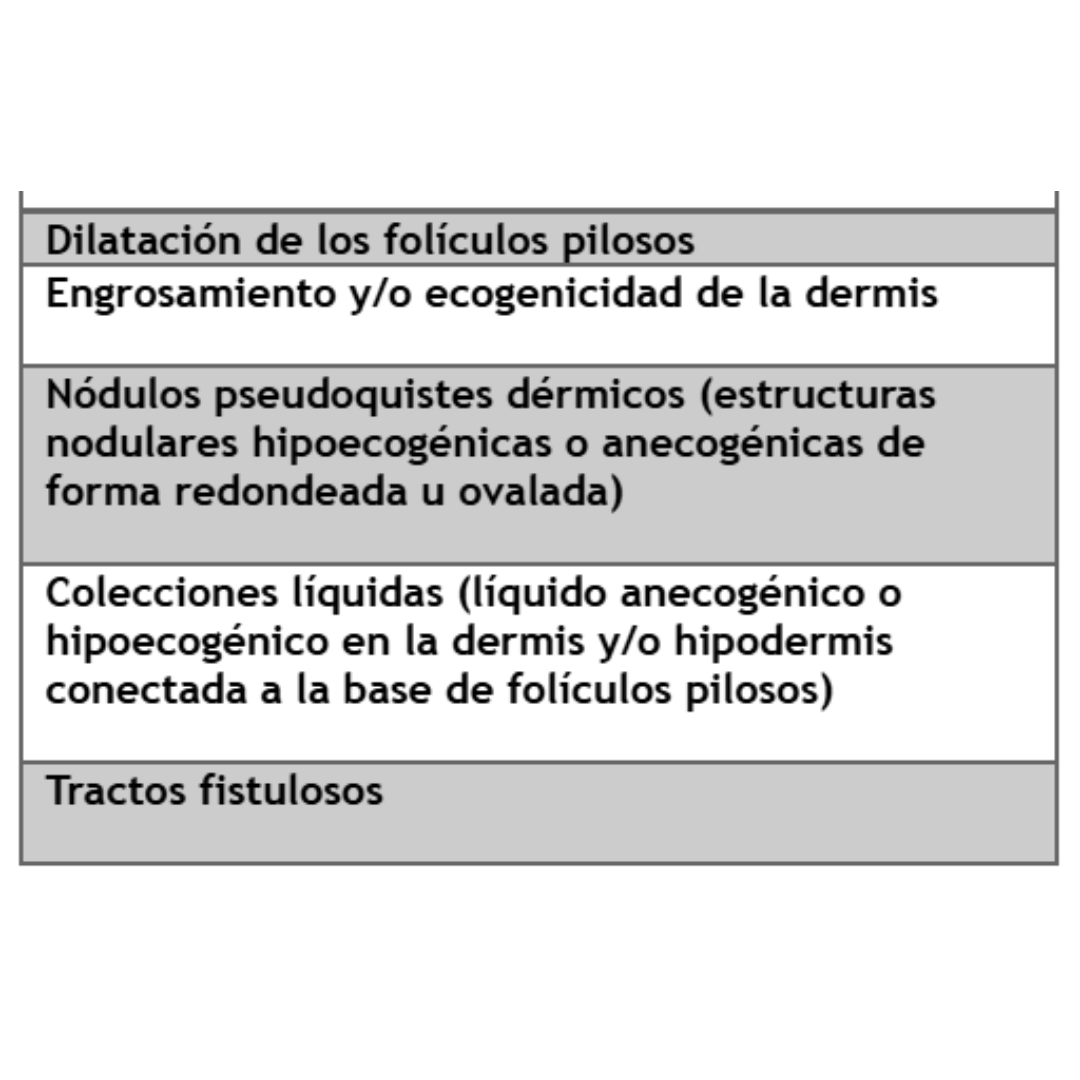
En la tabla 1 se describen los principales hallazgos ecográficos encontrados en HS y según la cantidad de ellos presentes se establece un grado de gravedad de la enfermedad.
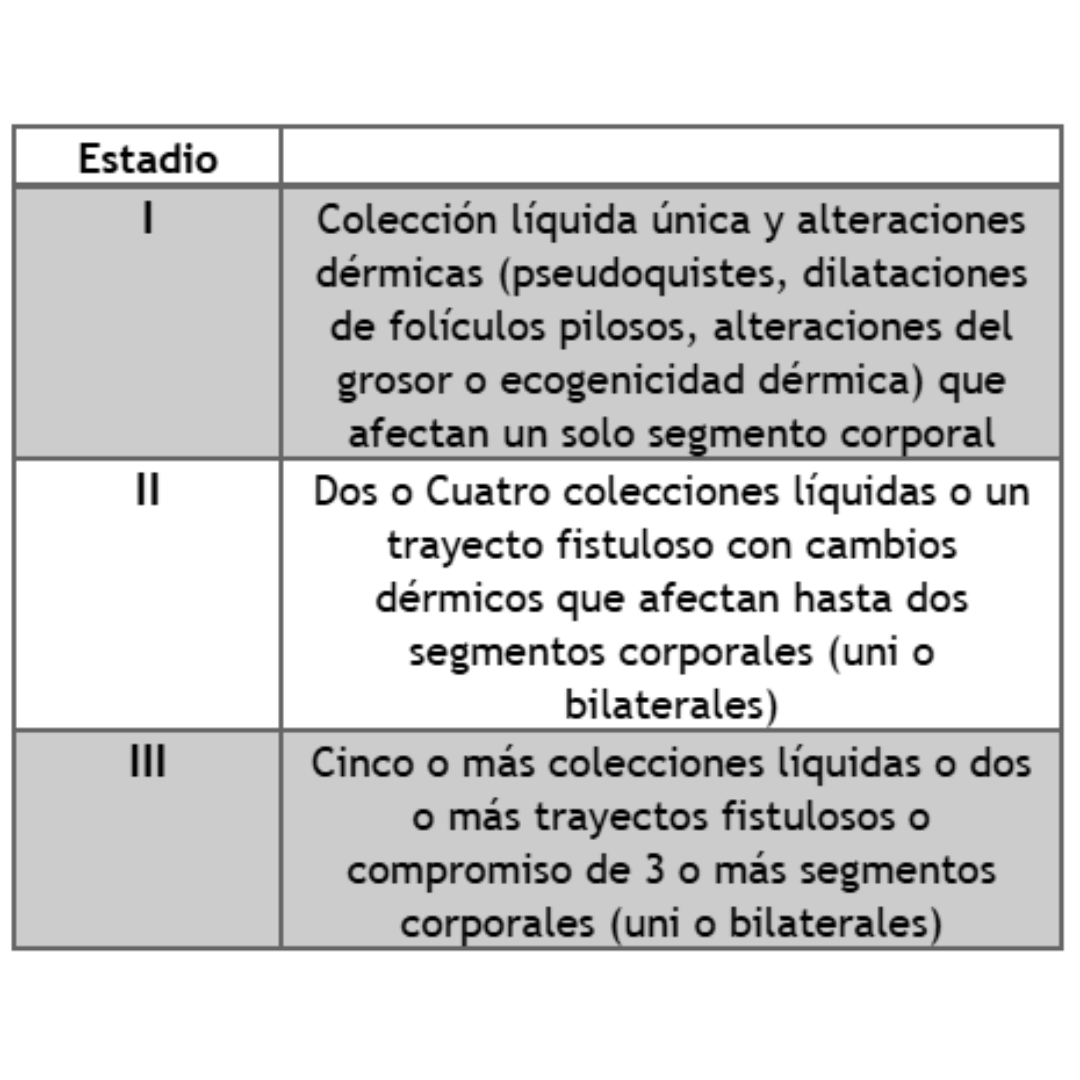
Tabla 1: Criterios Ecográficos para el diagnóstico de Hidradenitis Supurativa
Para el estadiaje se utiliza la clasificación de SOS-HS (sonographic Scoring of Hidradenitis suppurativa) que divide los grados de gravedad en 3. Se describen en tabla 2.
Tabla 2: Estadiaje de gravedad de hidradenitis SOS-HS
La categorización de estas fistulas es principalmente determinado por la presencia de cicatrices fibróticas. La presencia de edema puede revertirse y variar según el nivel de inflamación.
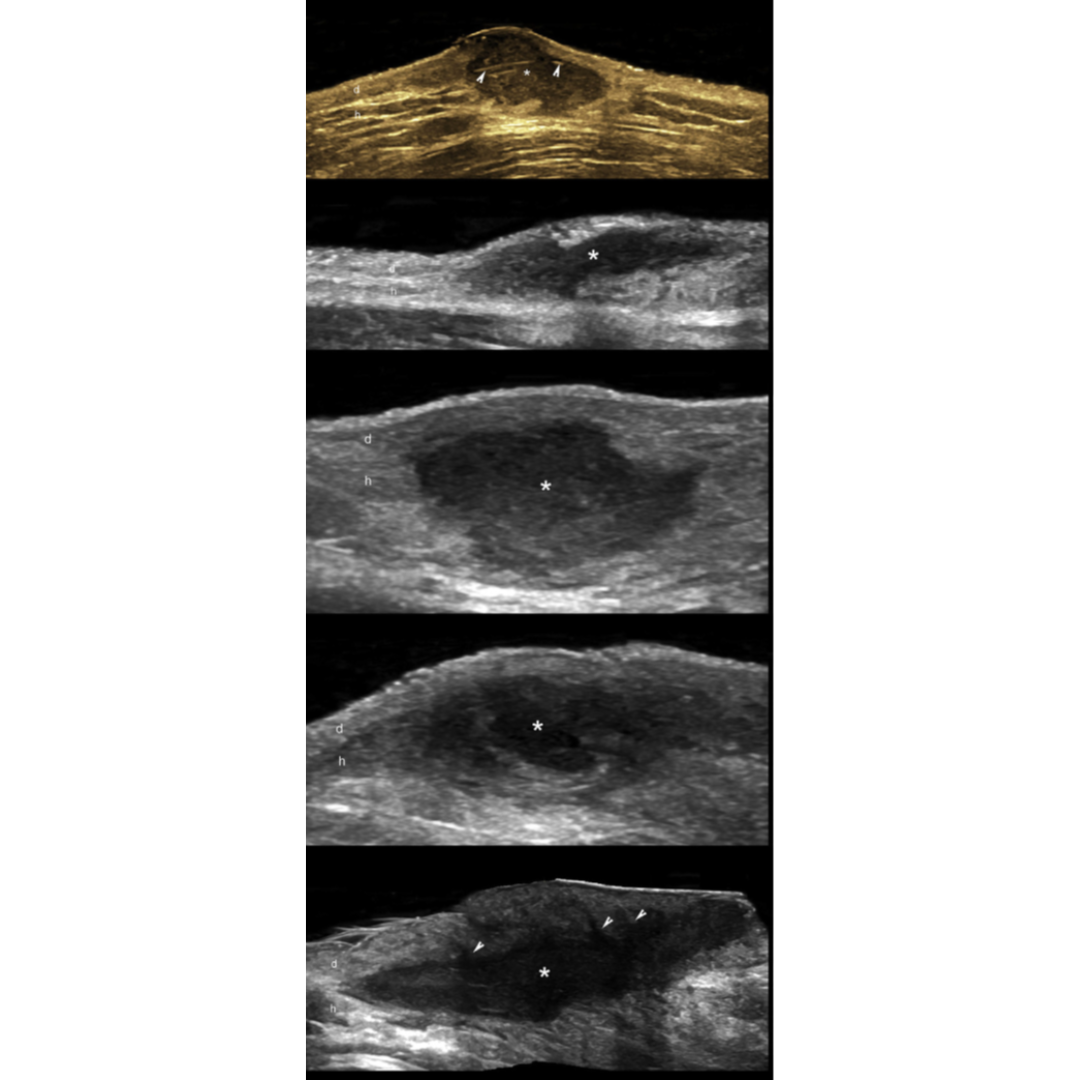
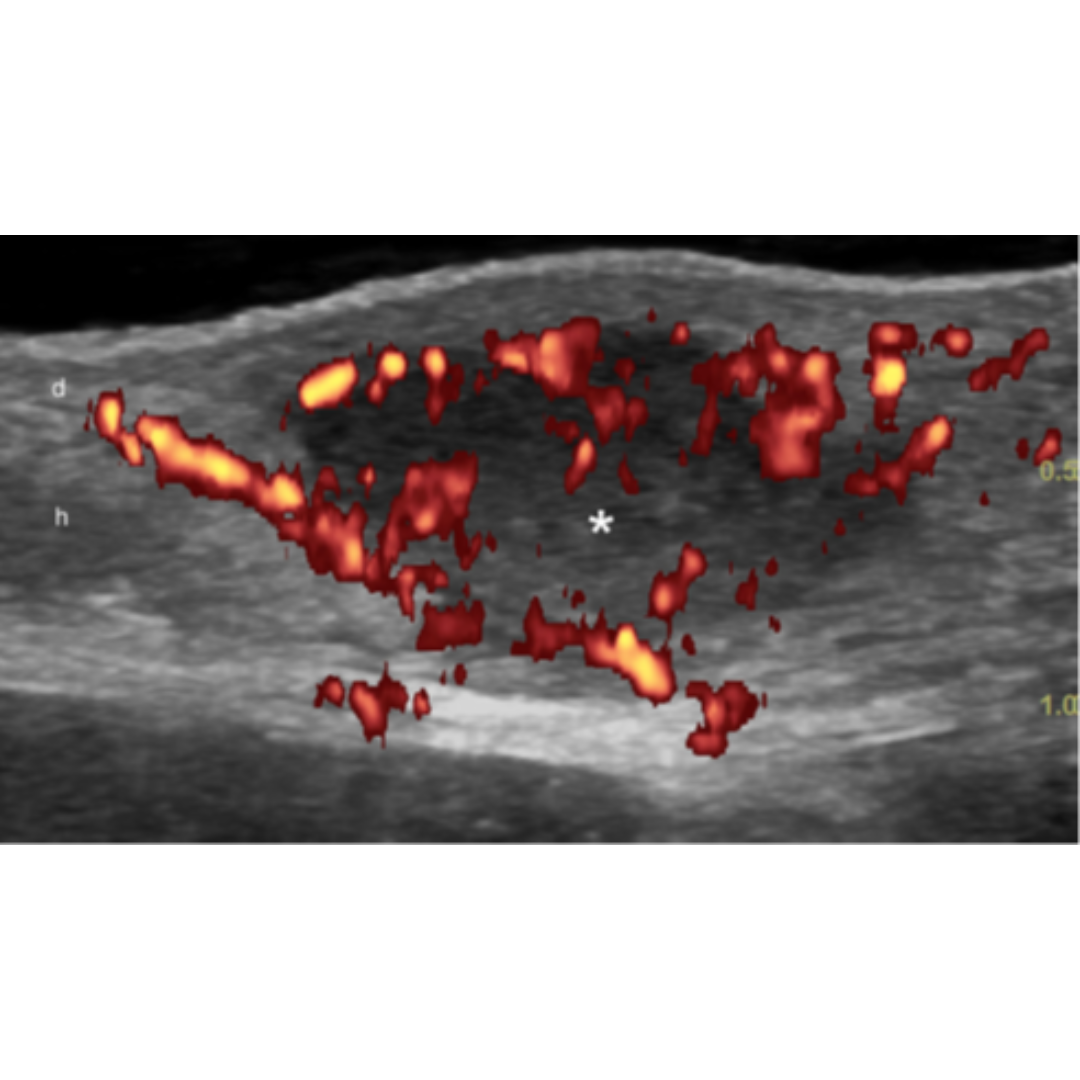
Existe además del estadio la clasificación del trayecto fistuloso descrito en la tabla 3, esta clasificación se basa en el Grado de fibrosis y edema de los trayectos fistulosos. Ecográficamente los grados de fibrosis se observan como halos rodeando las fistulas (figura 8) y el edema se observa rodeando los trayectos fistulosos como áreas hipoecogénicas en la hipodermis ejemplificados en figura 7. El grado de edema también se relaciona con la presencia de vascularización interna de la fistulas (figura 6).
Tabla 3: Clasificación ecográfica de trayectos fistulosos en hidradenitis supurativa.
Figura 5: Hidradenitis supurativa con una inflamación activa. La señal a Power Doppler demuestra un aumento del flujo sanguíneo de la lesión y en la periferia.
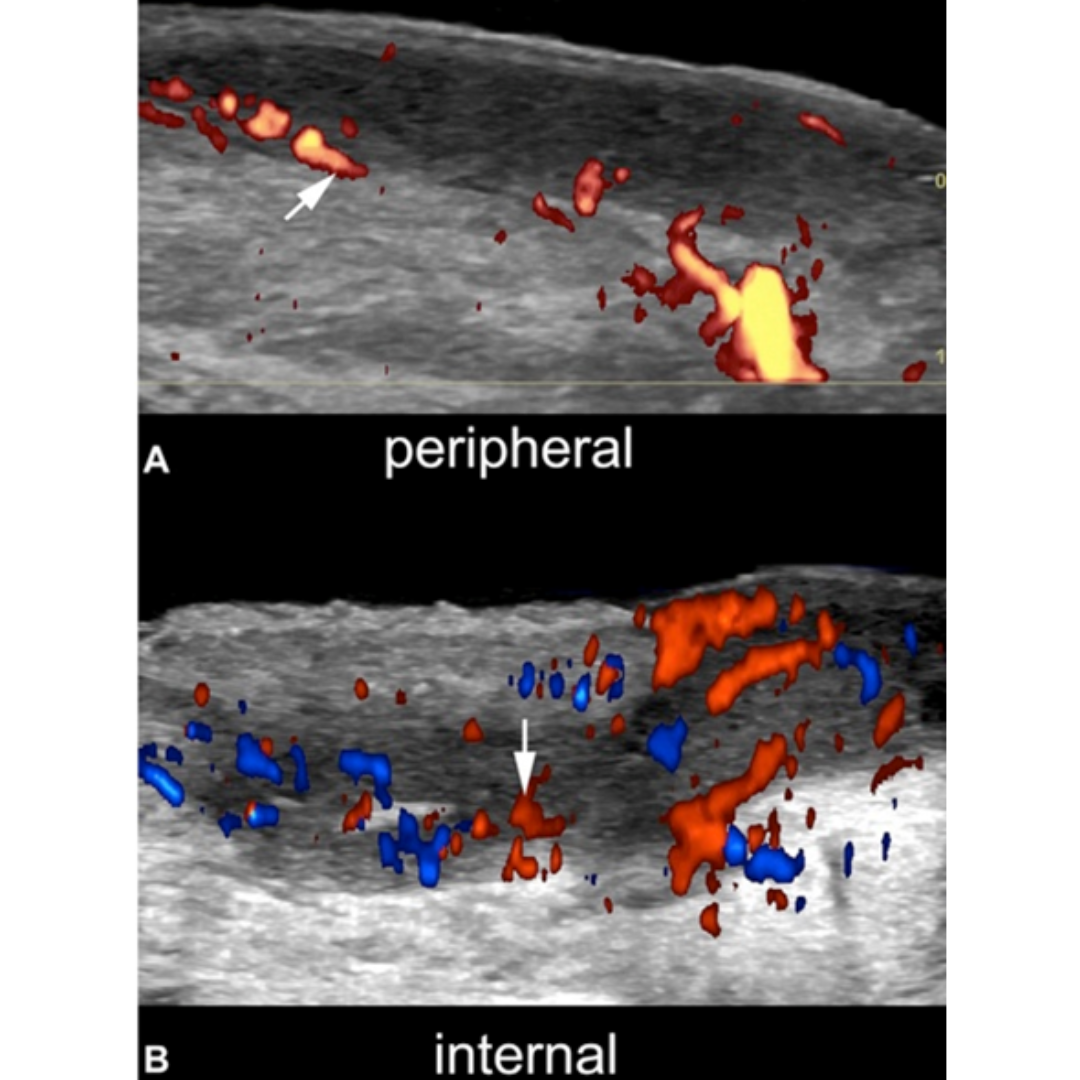
La clasificación del grado de edema y fibrosis es relevante para el tratamiento, mientras mayor es la fibrosis más baja será la respuesta a tratamiento sistémico.
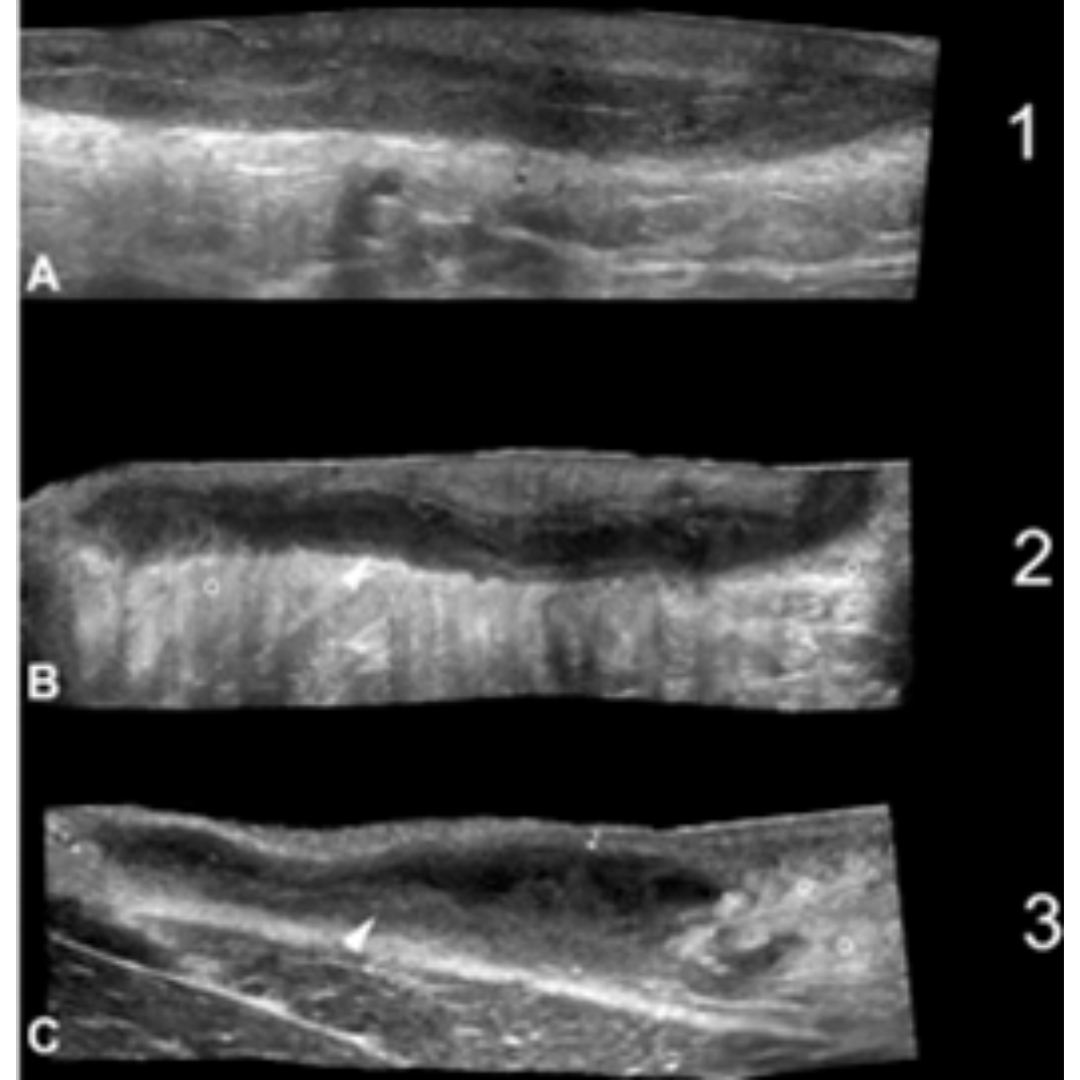
Figura 6: Tipos de vascularización de HS. Patrones de trayectos fistuloso (A) periférico, (B) interno. La vascularización interna en B también se encuentra asociada a vascularización periférica. Flecha oblicua: Vascularización periférica, Flecha vertical: Vascularización interna.
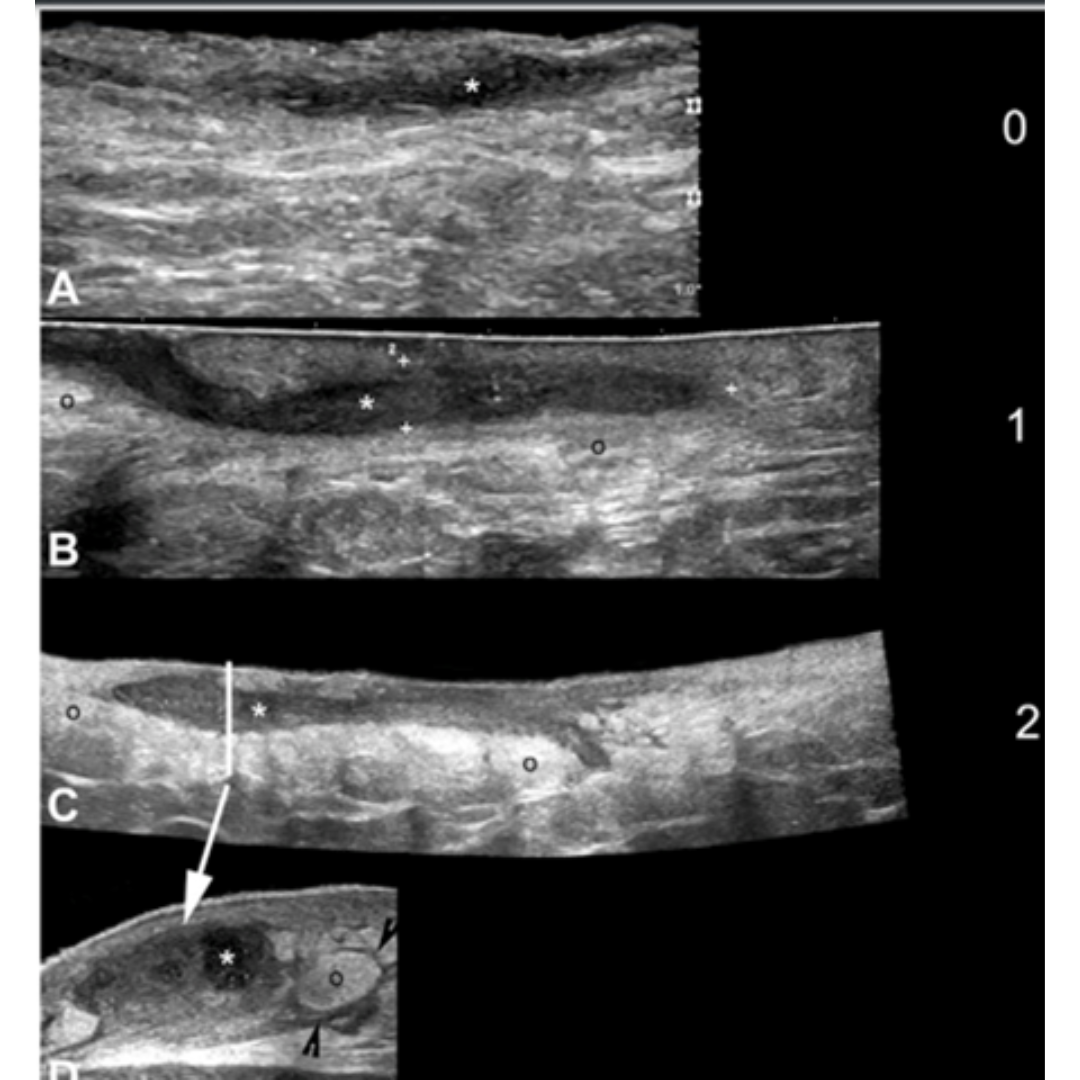
Figura 7: A a D de menor a mayor edema. Se muestra la clasificación de Edema hipodérmico (o) adyacente los trayectos de folículos de HS. Se observan imágenes en modo B con campo de visión extendido demostrando el eje largo de las fistulas (*). En D una vista transversal del trayecto fistulosos (*) es mostrado con grado 2 de edema (o). Se observa liquido hipoecoico (puntas de flechas negras) entre los lóbulos grasos en D*.
Figura 8: El signo de halo (flechas) en HS representa trayectos fistulosos con cicatrización fibrótica grado 2. B, C y D muestran diferentes tractos fistulosos con cicatrización fibrosa grado 2. Note el borde hipoecogénico (puntas de flechas oblicuas) rodeando las fístulas. Los fragmentos lineales hiperecogénicos en algunas de las fistulas sugieren fragmento del tracto piloso (flechas verticales en A y C)
Figura 9: Tipos de fístulas de tractos en HS. Clasificación tipo 3 (C) muestra el borde grueso hipoecogénico (punta de flecha), que sugiere cicatrización fibrótica en la periferia del trato fistuloso y el edema (o) del tejido graso hipodérmico en comparación con los tipos anteriores. (o) edema hipodérmico; es un marcador positivo de los bordes del trayecto fistuloso.
Conclusión
Conocer las características ecográficas de la HS nos permitirán reconocerla y diferenciarla de diagnósticos similares como abscesos, quistes epidérmicos complicados, etc. También el demostrar en detalle aspectos ecográficos como el edema adyacente a la fístula, el correcto uso de Power Doppler, el halo fibrótico de las fístula, serán de gran utilidad para el tratante y definirá la conducta terapéutica. Por lo tanto, el conocimiento acabado de los hallazgos ecográficos en modo B como bajo Doppler serán necesarios para que el ecografista pueda realizar un abordaje satisfactorio para los pacientes.
Referencias
Chen X, Guffey DJ. Topical timolol for treatment of persistent granulation tissue in the setting of severe hidradenitis suppurativa. Dermatol Online J. 2019; 25 (11): 13030/qt5fc1c5s5. [ Links ]
Reyes-Baraona, Francisco, Herane, María Isabel, Wortsman, Ximena, Figueroa, Andrés, García-Huidobro, Isidora, Giesen, Laura, Kolbach, Marianne, Molina, María Teresa, Muñoz, Leoncio, Saavedra, Daniela, & Silva-Feistner, Marcos. (2021). Guía clínica chilena para el estudio y tratamiento de hidradenitis supurativa. Resumen ejecutivo. Revista médica de Chile, 149(11), 1620-1635. https://dx.doi.org/10.4067/S0034-98872021001101620
Wortsman, X., Castro, A., & Figueroa, A. (2016). Color Doppler ultrasound assessment of morphology and types of fistulous tracts in hidradenitis suppurativa (HS). Journal of the American Academy of Dermatology, 75(4), 760–767. doi:10.1016/j.jaad.2016.05.009
Ximena Wortsman, Maryland. 2016
Wortsman X, Moreno C, Soto R, Arellano J, Pezo C, Wortsman J. Ultrasound in-depth characterization and staging of hidradenitis suppurativa. Dermatol Surg. 2013; 39 (12): 1835-42. [ Links ]
Hiperparatiroidismo Primario: Hallazgos ecográficos esperables
TM Daniela Fuenzalida Valenzuela - TM Elizabeth Vidal Mansilla
Objetivo
Se realiza una revisión anatómica y representación ecográfica del hiperparatiroidismo. La ecografía es una técnica útil y accesible que en ecografistas entrenados ha demostrado tener una sensibilidad cercana al 85% para pesquisar la presencia de adenomas paratiroideos (APT). Revisaremos las características ecográficas de los adenomas que nos será de gran ayuda para identificarlos y diferenciarlos de lesiones que pueden tener un aspecto similar.
Figura 1: Glándula Tiroides morfológicamente normal.
Figura 2: Lóbulo tiroideo derecho en longitudinal.
Revisión del tema
El hiperparatiroidismo primario (PHPT) es un trastorno endocrino común derivado de la elevación del metabolismo fosfo-cálcico que afecta fundamentalmente a mujeres entre 50 a 70 años. Cerca del 85% de las causas de PHPT corresponde a la presencia de un adenoma paratiroideo, un 15% a la hiperplasia de paratiroides, y muy raramente a un adenocarcinoma.El tratamiento de elección para el PHPT es la paratiroidectomía.
Actualmente la ecografía de cuello y la gammagrafía son los estudios más utilizados para la localización preoperatoria de las glándulas, sin embargo, este último presenta dificultades de accesibilidad en nuestro país.
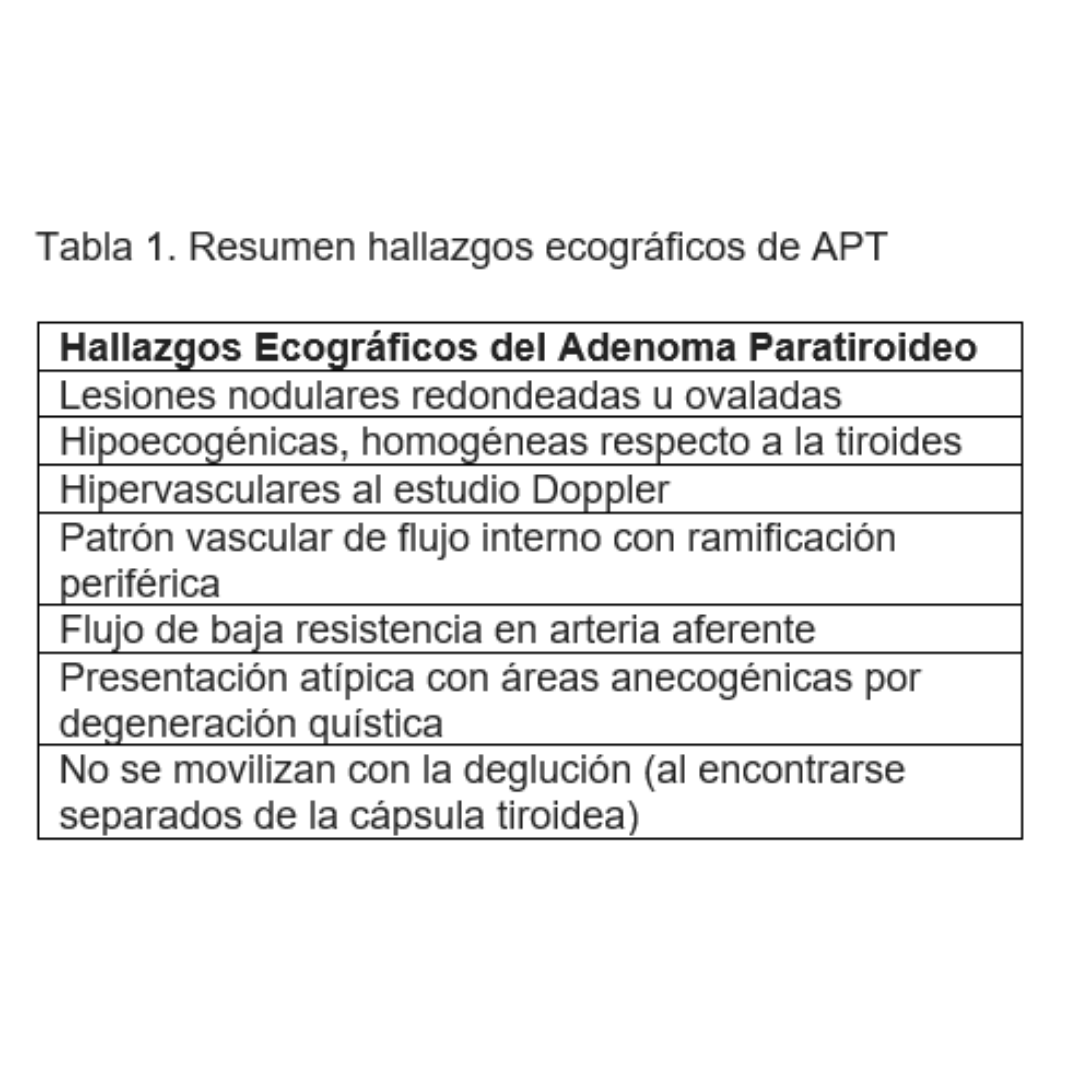
Las paratiroides en condiciones normales no se identifican claramente bajo ecografía. Habitualmente los APT se observan como lesiones redondeadas, hipoecogénicas, homogéneas, hipervasculares al Doppler, con flujo de baja resistencia en su arteria aferente. En casos de diagnóstico complejo es útil realizar deglución para observar movilidad, es esperable que un adenoma no se movilice en la deglución.
Entre el 1 y el 4% de los APT pueden manifestarse como lesiones completamente quísticas o mixtas, teniendo una porción sólida irrigada por un vaso polar. Estos adenomas son un desafío para las pruebas de imagen, además pueden ser o no funcionantes, por lo que no todos se manifestarán con elevación de la paratohormona.
Existen estructuras normales como son los ganglios ubicados en el segmento central y los nódulos tiroideos ubicados muy inferiormente, que pueden parecer similares a los APT. En estos casos es útil observar el límite de la capsula tiroidea y el patrón vascular, ya que los ganglios carecen de vascularización periférica o subcapsular.
La hiperplasia de paratiroides es la segunda causa más frecuente de HPT. Se considera hiperplasia cuando existe más de una glándula aumentada de tamaño; esto significa que bajo ecografía se observará más de un nódulo con características ecográficas de adenoma (figura 6).
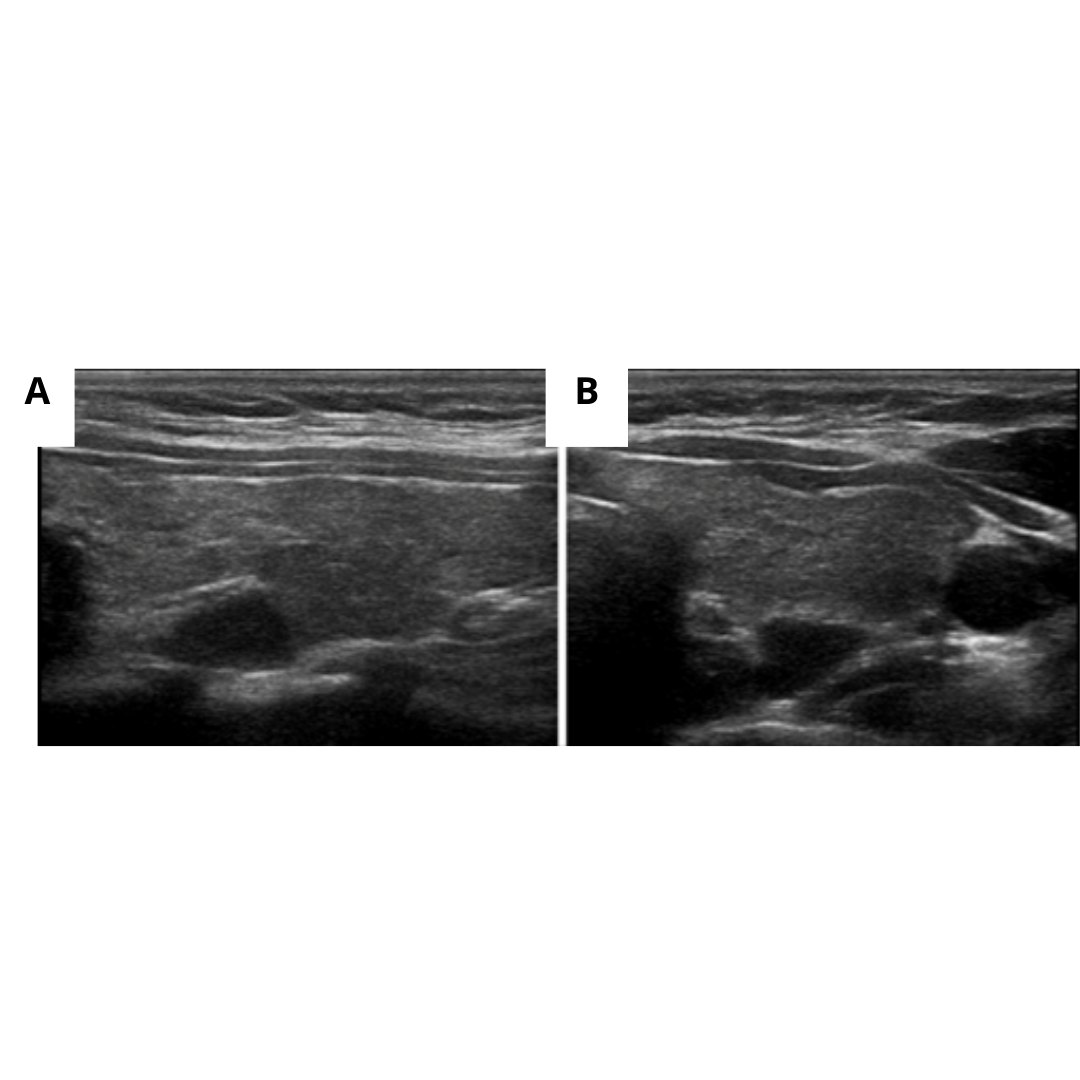
Figura 3. Adenoma paratiroideo superior izquierdo. Exploraciones longitudinales (A) y transversales (B). El parénquima tiroideo adyacente se observa hipoecogénico, heterogéneo como resultado de tiroiditis crónica autoinmune.
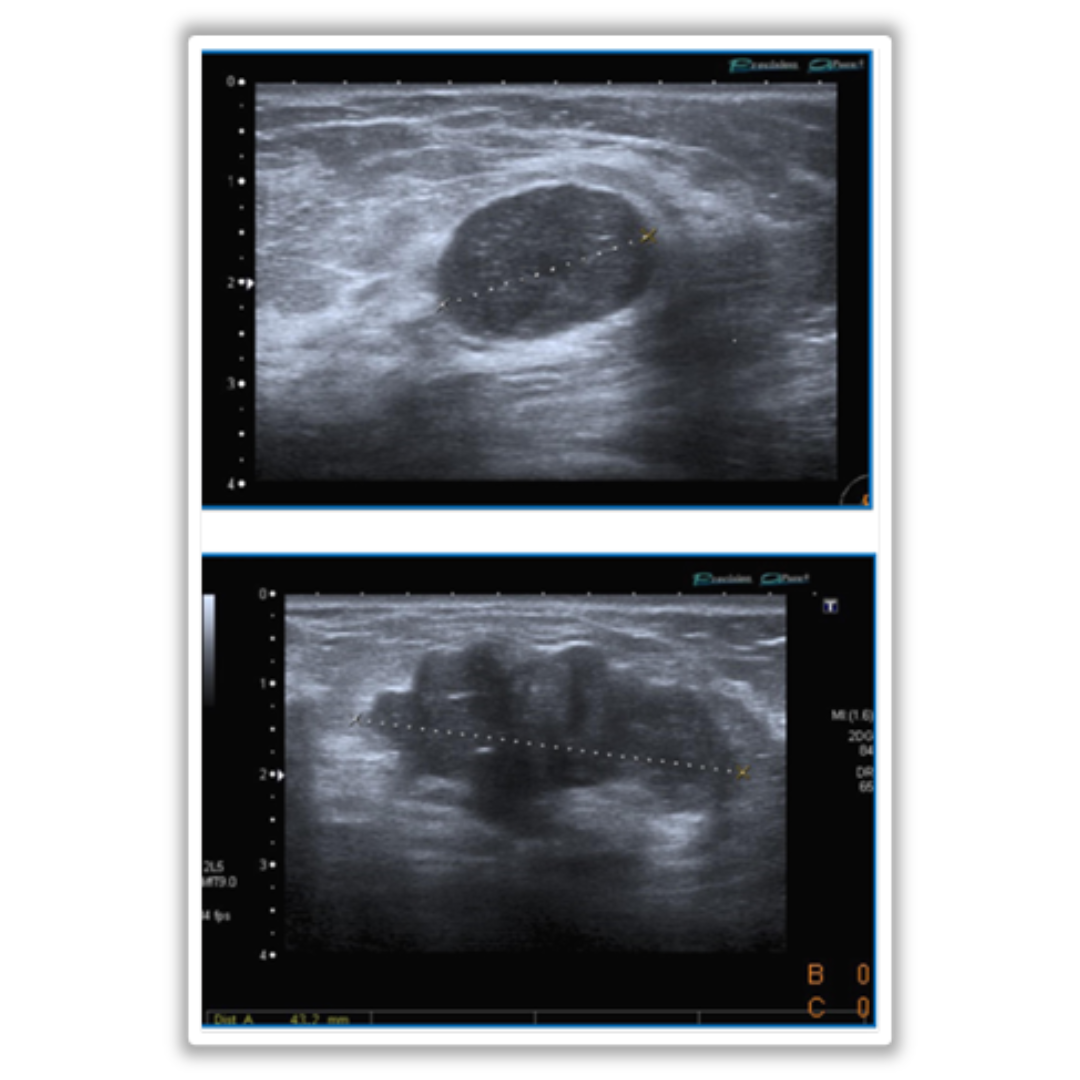
Figura 4: Adenoma infratiroideo de la glándula paratiroides
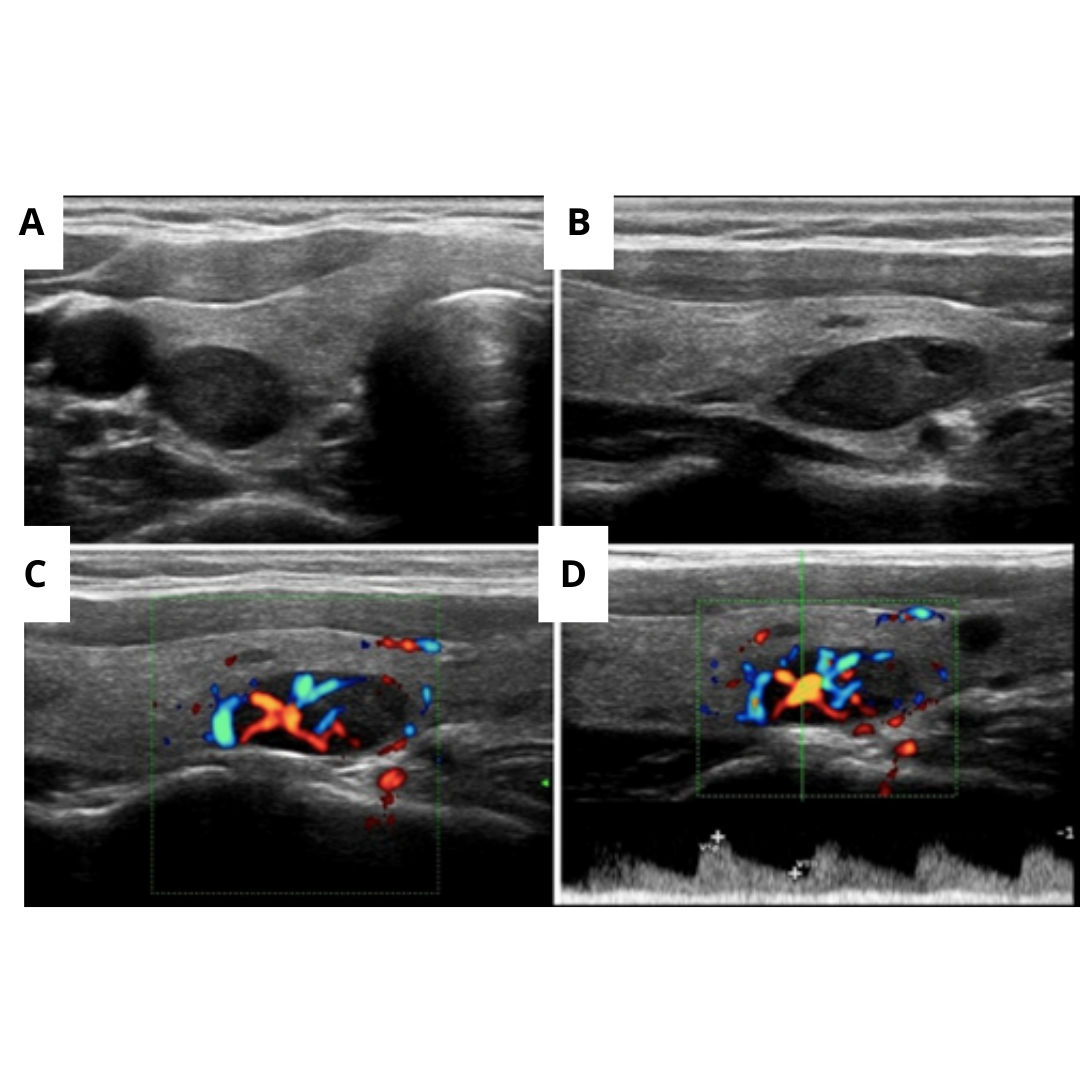
Paciente con imágenes nodulares en (A) transversal, (B) longitudinal, (C) longitudinal con Doppler color, y (D) Doppler espectral de la Arteria Aferente que reveló un flujo típico de baja resistencia.
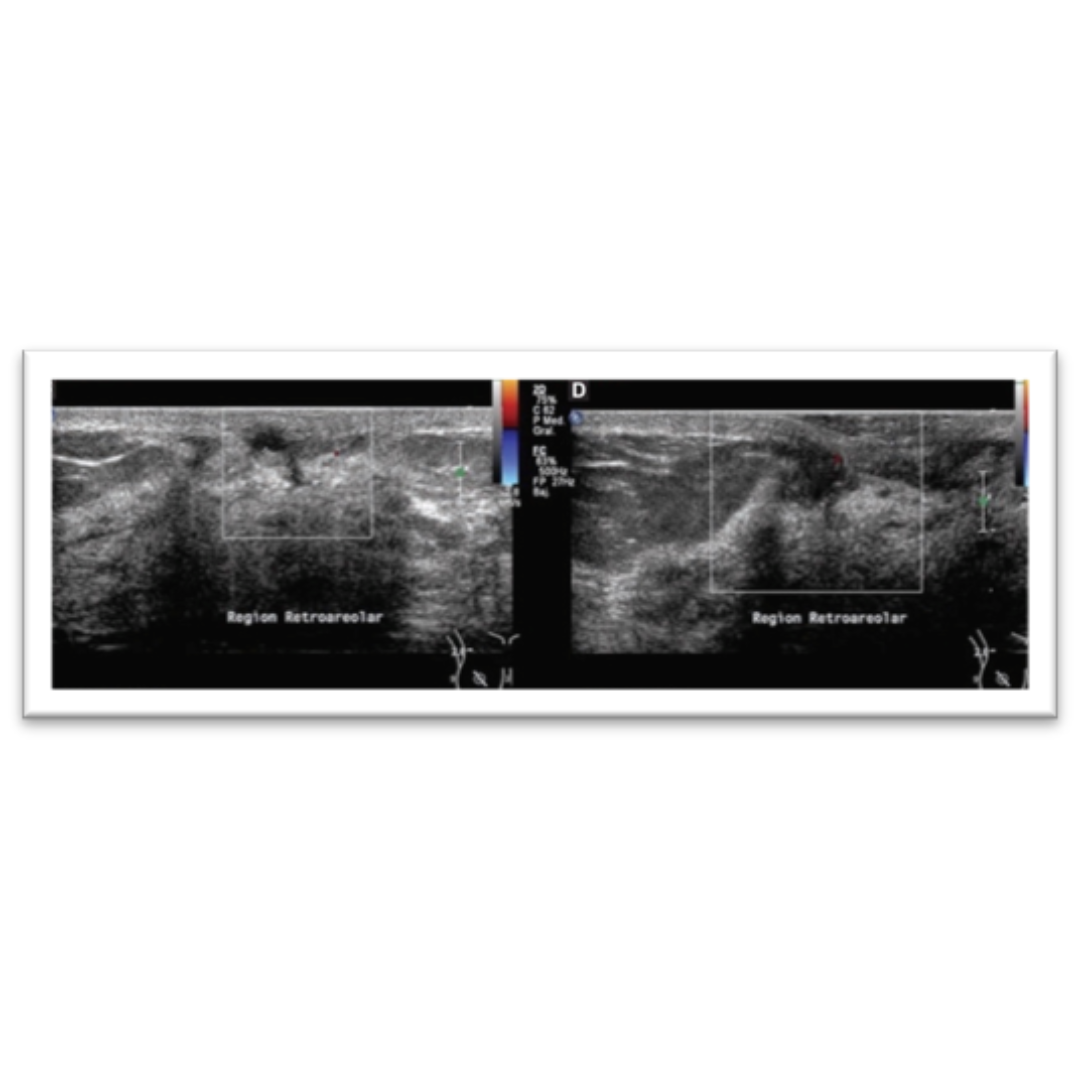
Figura 5: Ecografía de cuello que muestra lesión hipoecogénica profunda al polo inferior del lóbulo tiroideo derecho (flecha verde). La lesión corresponde a un nódulo heterogéneo solido-quístico, con flujo al Doppler en el componente sólido.
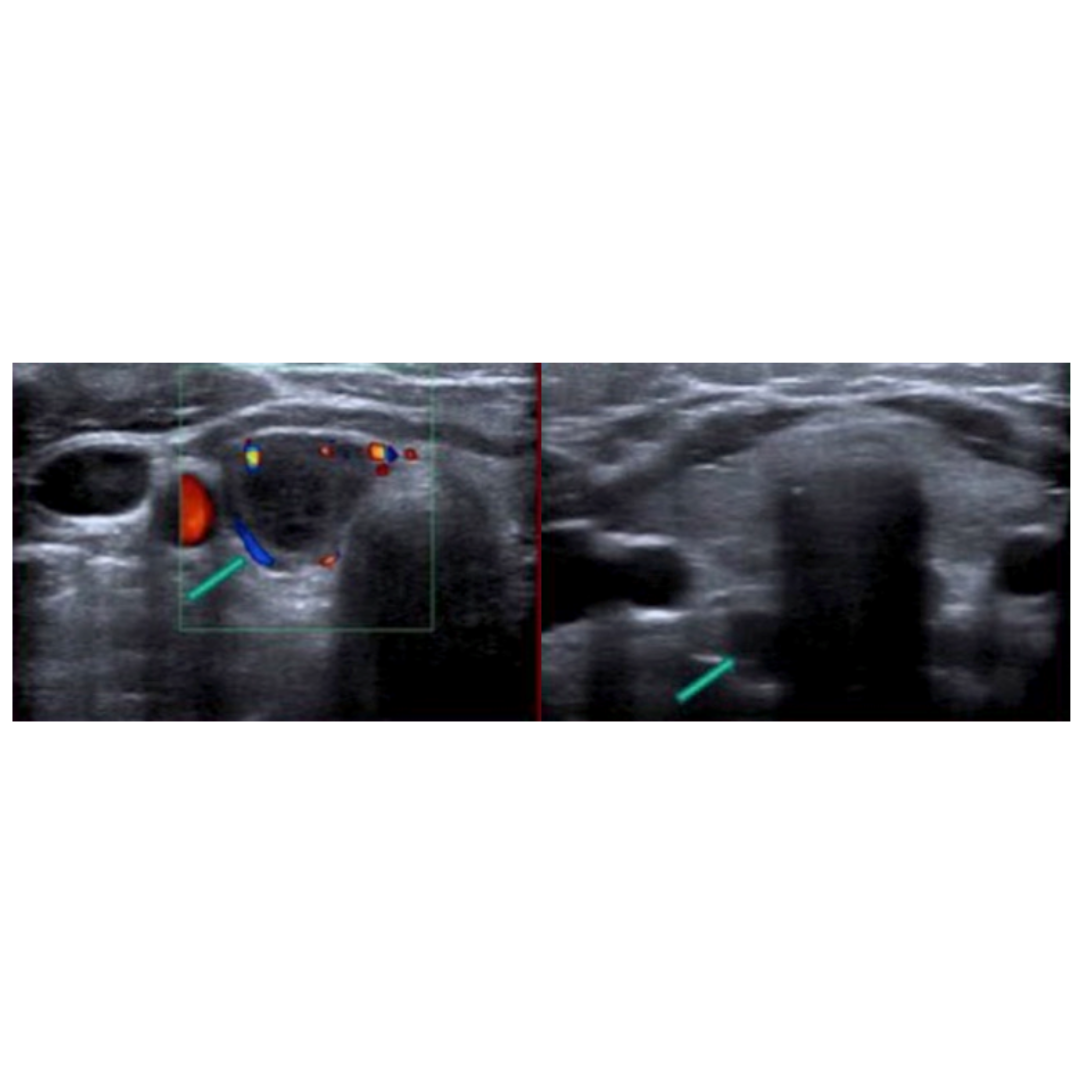
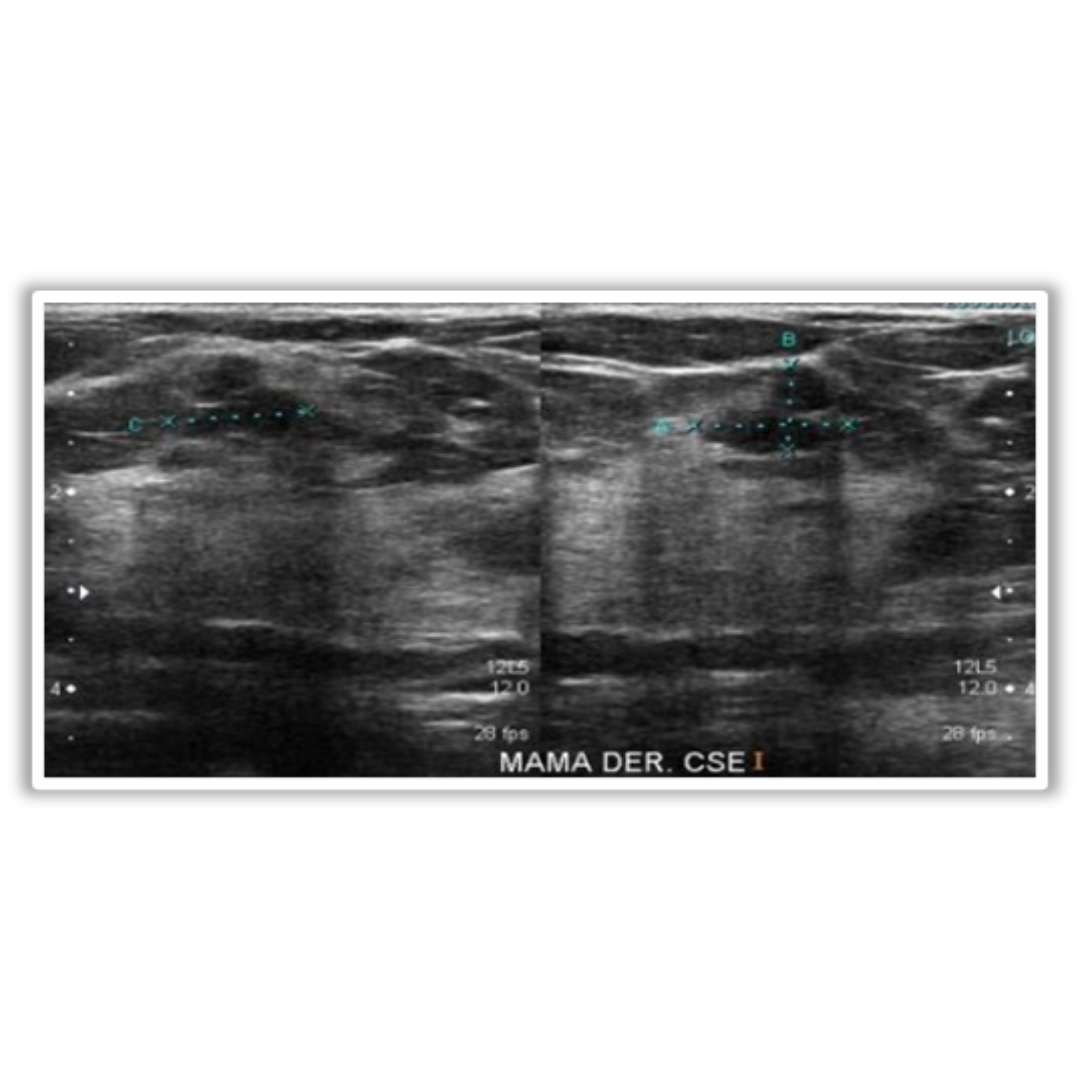
Figura 6: Hiperplasia de paratiroides: Ecografía muestra múltiples lesiones nodulares redondeadas/ovaladas, hipoecogénicas y con flujo Doppler interno (flechas), localizadas en borde posterior de ambos lóbulos tiroideos.
Conclusión
En el día a día, enfrentarse a lesiones nodulares infratiroideas siempre será un desafío, pero tener un conocimiento adecuado de las características ecográficas de los APT facilitará lograr una correcta demostración de estos casos.
El uso de la ecografía como examen pre operatorio del adenoma paratiroideo es ampliamente usado debido a la elevada sensibilidad que presenta la ecografía en la actualidad y por la baja accesibilidad que existe en las distintas regiones para realización de gammagrafía, por lo tanto, realizar la ecografía en manos expertas es fundamental para alcanzar una elevada sensibilidad.
Referencias
1. Chien D, Jacene H. Imaging of parathyroid glands. Otolaryngol Clin North Am. 2010 Apr;43(2):399-415, x. doi: 10.1016/j.otc.2010.01.008. PMID: 20510723.
2. Johnson NA, Carty SE, Tublin ME. Parathyroid imaging. Radiol Clin North Am. 2011 May;49(3):489-509, vi. doi: 10.1016/j.rcl.2011.02.009. PMID: 21569907
3. Pérez Dávila, M., Ferreiro Arguelles, C., Barón Ródiz, P., Camacho Oviedo, J., Nuñez Valentín, P., & Cervera Rodilla, J. L. (2018). Hiperparatiroidismo en imagen:: cuándo, cómo y dónde buscarlo. Seram. Recuperado a partir de https://www.piper.espacio-seram.com/index.php/seram/article/view/1547
4. Vitetta, G. M., Neri, P., Chiecchio, A., Carriero, A., Cirillo, S., Mussetto, A. B., & Codegone, A. (2014). Role of ultrasonography in the management of patients with primary hyperparathyroidism: retrospective comparison with technetium-99m sestamibi scintigraphy. Journal Of Ultrasound, 17(1), 1-12. https://doi.org/10.1007/s40477-014-0067-8
Carcinoma Papilar Esclerosante Difuso de Tiroides
TM Sofía Concha Mella - TM Elizabeth Vidal
Objetivo
El carcinoma papilar esclerosante difuso (CPED) es poco frecuente y se define como una afectación difusa de uno o ambos lóbulos de la tiroides con numerosos cuerpos de Psamoma, metaplasia escamosa extensa e infiltración linfocítica pronunciada a nivel histológico (3). Puede presentar un comportamiento clínico agresivo como metástasis a ganglios linfáticos, que serán necesario representar bajo ecografía. El CPED es de difícil diagnostico y un desafío diario para los ecografistas, ya que su presentación no siempre es visible con transductores de 12 MHz, sobre todo en estadios iniciales, los cuerpos de Psamoma dispersos en el parénquima pueden no destacar en el parénquima tiroideo. A continuación revisaremos las principales características CPED que nos ayudará a pesquisarlos.
Revisión del tema
El Carcinoma papilar esclerosante difuso se presenta en pacientes jóvenes entre 18 – 29 años, afectando a mujeres y hombres por igual. Clínicamente se manifiesta como un aumento difuso palpable, afectando a uno o ambos lóbulos. Puede provocar compresión local de los órganos del cuello, como disfagia, disfonía y disnea, o presentarse de manera asintomática (7).
A continuación se describirán los patrones malignos ecográficos que pueden presentar los nódulos tiroideos, clasificación TI RADS (ACR) y qué signos ecográficos llevarán a un probable diagnóstico de carcinoma papilar esclerosante difuso.
Clasificación Tirads ACR
Sistema estandarizado de informe de las lesiones tiroideas para estratificar el riesgo de malignidad de los nódulos (1).
Los bordes irregulares indican una posible infiltración del parénquima glandular adyacente y las microcalcificaciones (MCC) son el hallazgo más específico de malignidad, con una especificidad del 85-95%, en especial en relación con el carcinoma papilar de tiroides. Estas corresponden a depósitos cálcicos basofílicos de aspecto laminar, denominados como cuerpos de Psamoma (2,8).
Las lesiones sólidas, hipoecogénicas, mal definidas, con microcalcificaciones puntiformes, y que estas también se presenten de manera difusa, se clasificarán como TI RADS 5
Hallazgos Ecográficos Lesión Tiroidea Maligna
Ecogenicidad: Sólido, hipoecogénico
Forma: más alto que ancho
Márgenes: irregulares o microlobulados
Microcalcificaciones o gruesas calcificaciones
Fig1. Esquema patrones malignos
Hallazgos Ecográficos Sugerentes de Carcinoma Papilar Esclerosante Difuso
Según diferentes estudios (3,5,6,9), el carcinoma papilar esclerosante difuso, a nivel ecográfico, la glándula tiroides se visualizará aumentada de tamaño, hiperecogénica, heterogénea, con imágenes puntiformes dispersas correspondientes a MCC, lo que se puede confundir en principio con tiroiditis. A este patrón, de imágenes puntiformes distribuidas en el parénquima se denomina como “tormenta de nieve”. Puede o no existir masa asociada, la cual se presentará como un nódulo sólido, hipoecogénico, de bordes mal delimitados y abundantes MCC que sugieren una invasión en curso.
En ambas presentaciones existirá un alto porcentaje de visualización de ganglios cervicales aumentados de tamaño, con MCC difusas, similares a las que se presentan en el parénquima tiroideo.
Fig2. A) Masa hipoecoica mal definida, con microcalcificaciones difusas y dispersas que ocupaban toda la glándula. B) Ganglio linfático cervical aumentado de tamaño con múltiples microcalcificaciones dispersas (2).
Fig3. (A) Numerosas microcalcificaciones en todo el lóbulo derecho como una “tormenta de nieve” sin nódulos en la sección longitudinal de la tiroides. (B) Patrón en “tormenta de nieve” en el lóbulo derecho con un nódulo hipoecoico de borde mal delimitado en el corte longitudinal de la tiroides (8).
A PROPÓSITO DE UN CASO
Paciente femenino; 36 años. Se presenta con motivo de consulta por aumento de volumen en región cervical anterior, de larga data, asintomática.
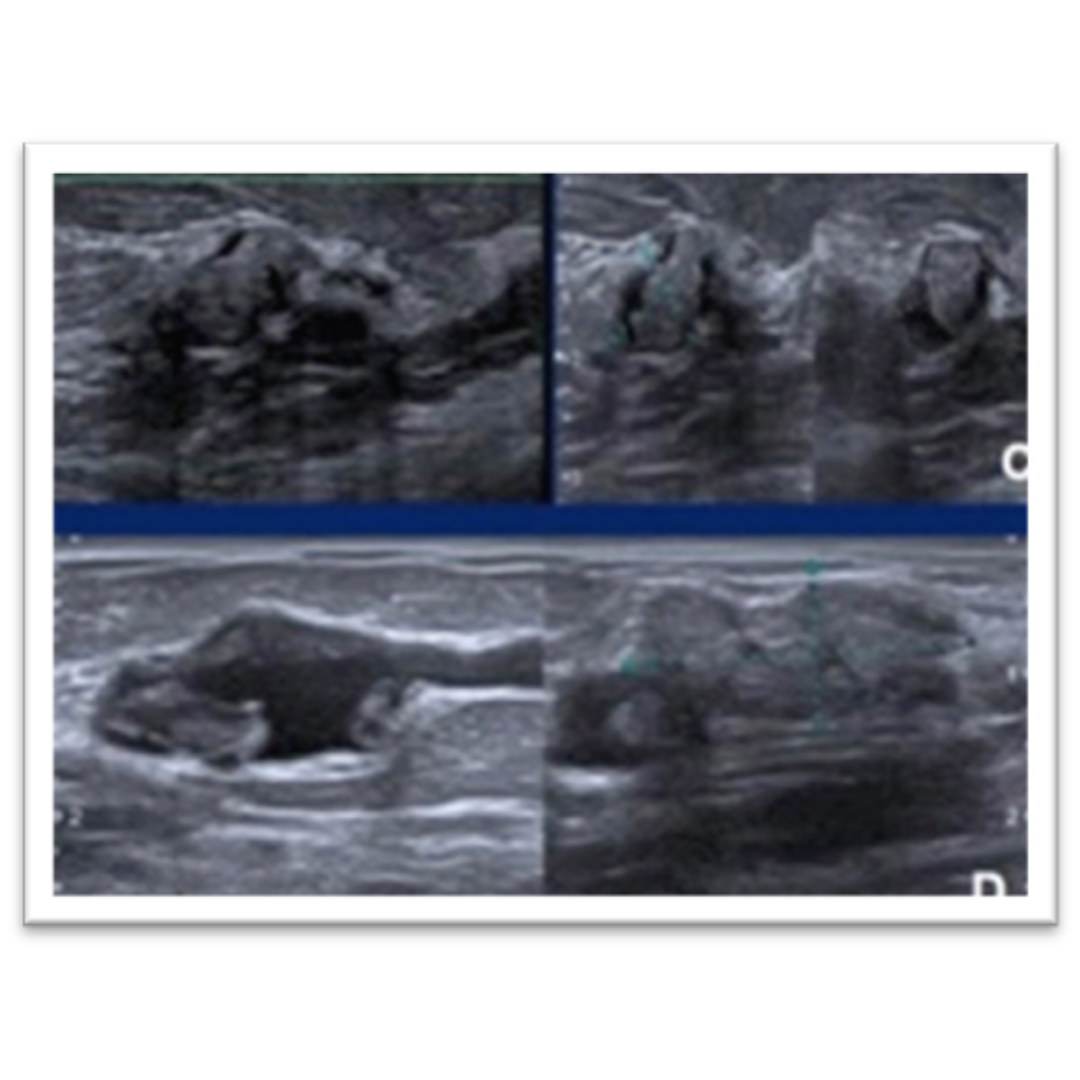
Fig4. (A) En lóbulo tiroideo derecho, 1/3 medio, se visualiza nódulo sólido, hipoecogénico, mal delimitado con múltiples calcificaciones puntiformes en su interior (cuerpos de Psamoma). (B) Estas también se presentan de manera difusa periféricas al nódulo. (C) En Región cervical derecha, GIV, se visualiza ganglio cervical aumentado de tamaño, con múltiples imágenes puntiformes hiperecogénicos en su periferia e interior sugerente de microcalcifcaciones.
Conclusión
La ecografía de tiroides es un examen que se considera una herramienta efectiva para evaluar el Carcinoma papilar esclerosante y la presencia de cuerpos de Psamoma. El uso de transductores de alta frecuencia es fundamental para identificar las microcalcificaciones, sobre todo aquellas que se encuentran dispersas en el parénquima y no están asociadas a nódulos. El realizar un estudio acabado de regiones ganglionares posterior al hallazgo de MCC será también de gran utilidad para identificar extensión tumoral.
Referencias
1. ACR Thyroid Imaging, Reporting and Data System (TI-RADS): White Paper of the ACR TI-RADS Committee Tessler, Franklin N. et al.Journal of the American College of Radiology, Volume 14, Issue 5, 587 – 595.
2. Bu Yun M, Shyam Sunda P. Ultrasonographic Features of Diffuse Sclerosing Variant of Papillary Thyroid Carcinoma Disponible en https://lc.cx/9ZKyFP
3. Chien-Chin Chen, Wen-Chung Chen, 2013. Diffuse sclerosing variant of thyroid papillary carcinoma: Diagnostic challenges occur with Hashimoto's thyroiditis. Disponible en: https://n9.cl/1bgas
4. Gutiérrez de Velasco, A. 2020. Carcinoma papilar difuso de tiroides: microcalcificaciones fuera del nódulo tiroideo Disponible en: https://n9.cl/xa31y
5. Li, W., Wang, Y., Gao, L. et al. Sonographic characteristics of diffuse sclerosing variant of papillary thyroid carcinoma with histopathological correlation: a preliminary study. Orphanet J Rare Dis 19, 136 (2024). https://doi.org/10.1186/s13023-023-02867-3
6. Manrique Franco K, Domínguez Fernández R, Lara Capellán JI, Renedo Pascual G, Rovira Loscos A. Carcinoma papilar de tiroides, variante esclerosante difusa. Endocrinol Nutr [Internet]. 2010;57(10):500–2. Disponible en: https://lc.cx/jO2tgY
7. Quintana Muñoz H, Peña Vega CP, Solarte PR. Carcinoma papilar esclerosante difuso de tiroides: reporte de un caso. Univ. Med. [Internet]. 6 de febrero de 2017 [citado 4 de octubre de 2024];57(3):391-40. Disponible en: https://revistas.javeriana.edu.co/index.php/vnimedica/article/view/17888
8. Romero, A. y Meza, I. 2010. Carcinoma papilar de tiroides, variante esclerosante difusa: un subtipo histológico de difícil diagnóstico. Revista Colombiana de Cancerología. 14, 4 (dic. 2010), 240–244.
9. Romero Lopez, D. L., Perez Benitez, D. M. A., Lorenzo Quesada, D. V., Luna Morales, D. A., De La Torre Colmenero, . R., & De Lara Bendahan, D. V. (2021). “SOLO ANTE EL TIROIDES”: Lo que el residente de radiología debe saber para la correcta caracterización y estratificación ecográfica del NÓDULO TIROIDEO. . Seram, 1(1). Disponible https://lc.cx/9B1wLH
Anatomía Ecográfica Muscular de Pared Torácica: lo que la Ecografista Mamaria debe saber
TM María Jesús Catalán, TM Elizabeth Vidal, TM Cristian Moya
Objetivo
El objetivo docente es realizar revisión anatómica principalmente muscular de la pared torácica de aquellos músculos que se encuentran adyacente a la zona mamaria. Cuando se realiza una ecografía mamaria los profesionales ecografistas deben reconocer las estructuras vecinas de la pared torácica para enfrentar casos como; ginecomastia, pacientes que consultan por mastalgia asociada trauma o pacientes que acuden con sintomatología muscular, donde se debe descartar la presencia de fracturas cercanas a la región mamaria.
Imagen 1: Principales músculos a conocer: pectoral, trapecio, dorsal ancho, romboides y serrato.
Revisión del tema
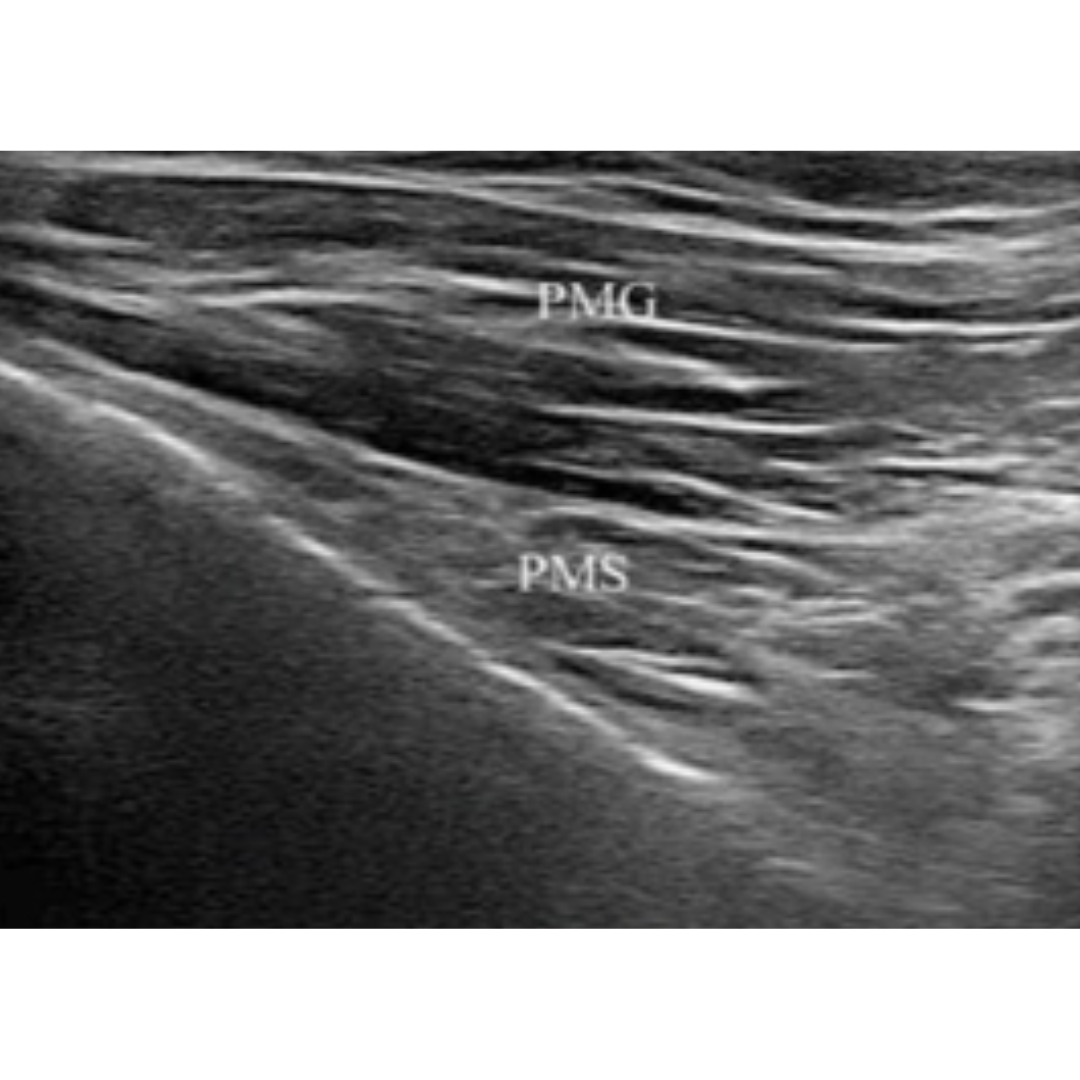
MÚSCULO PECTORAL MAYOR Y MENOR
Músculo grueso, en disposición de abanico/triangular, delante de pectoral menor y entre ambos tienen un trayecto perpendicular.
Origen: MúsculoPectoral mayor:2/3 mediales clavícula, desde la 1ra a la 6ta articulación esternocostal y vaina anterior de músculos rectos del abdomen. Musculo pectoral menor: cara anterolateral desde 3ra a 5ta costilla.
Inserción: Musculo pectoral mayor: cresta subtroquiteriana de forma cruzada. Musculo pectoral menor: apófisis coracoides.
Imagen 2: Corte transversal. : músculo pectoral mayor(PMG) y músculo pectoral meno (PMS)
MúSCULO TRAPECIO
Músculo de gran tamaño que se ubica en la cara posterior torácica.
Origen: línea nucal superior, protuberancia occipital externa, ligamento nucal, apófisis. Espinosas y ligamento Supraespinosos (C3-T12).
Inserción: tercio lateral clavícula, acromion y borde medial de espina escapular.
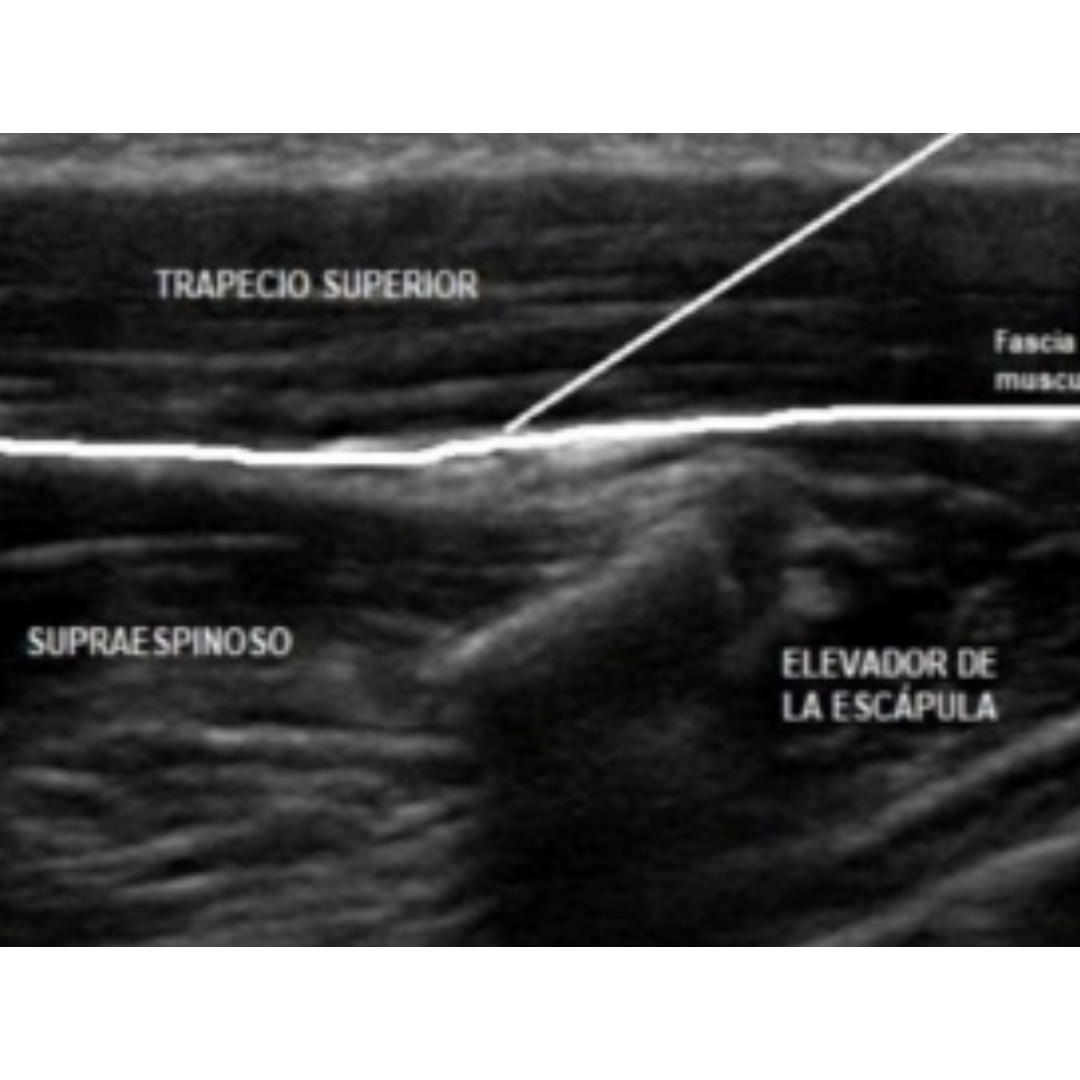
Imagen 3: Desde superficial a profundo: piel-subcutáneo-trapecio-supraespinoso-escápula.
MÚSCULO DORSAL ANCHO
Es el más ancho del cuerpo, se extiende por casi toda la superficie del dorso.
Origen: Ángulo inferior. Escapular, apófisis. Espinosas (T7-T12), costillas (9na-12va) y cresta iliaca
Inserción: Surco intertubercular del húmero
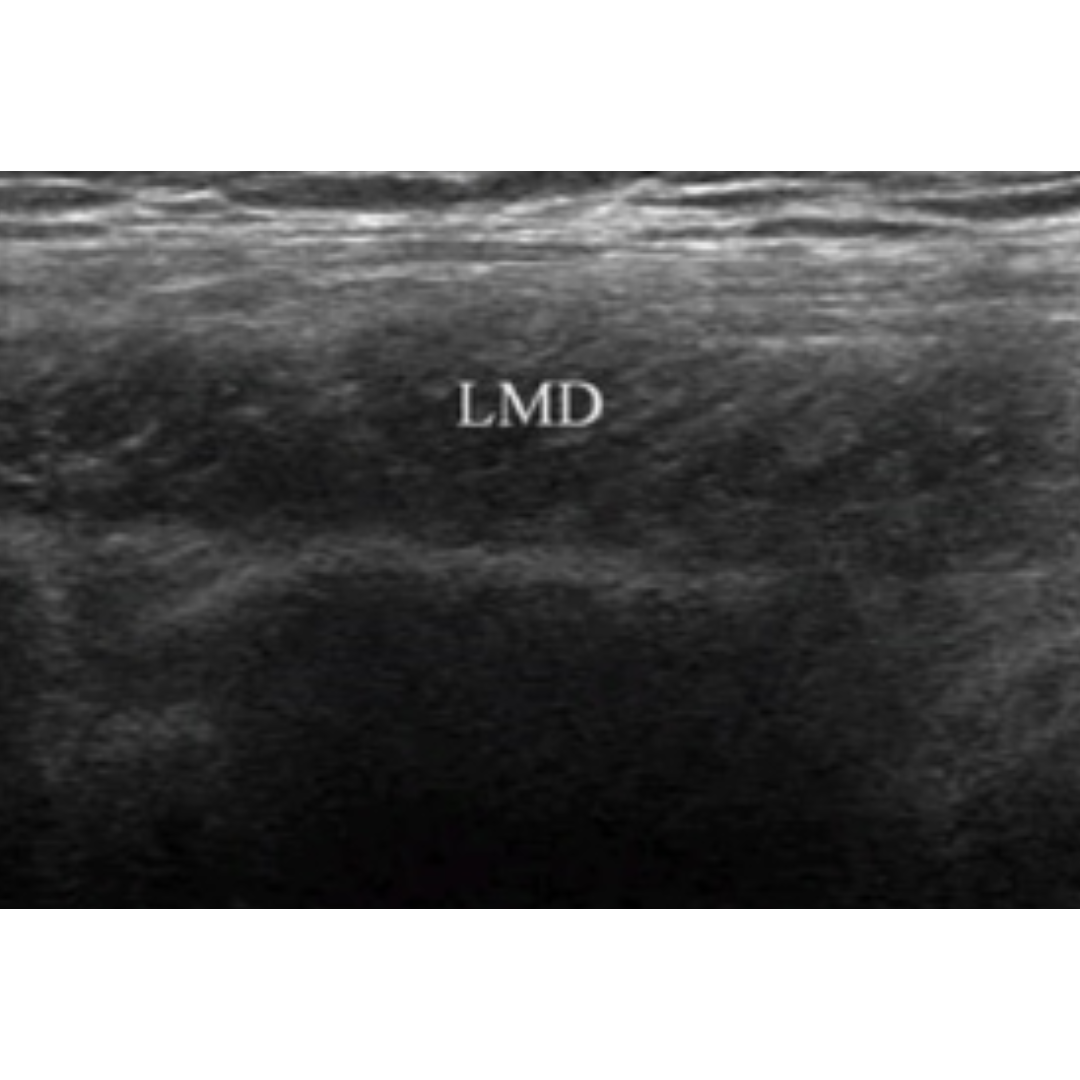
Imagen 4: Corte longitudinal. LMD: músculo dorsal ancho
MÚSCULO ROMBOIDES MAYOR Y MENOR
Son más pequeños que los ya mencionados y de forma cuadrangular. Ubicados entre columna vertebral y borde medial escapular.
Origen: Músculo romboides mayor: apófisis. espinosas (T2-T5). Musculo romboides menor: ligamento. Nucal y apófisis. espinosas (C7-T1)
Inserción: Borde medial escapular Musculo romboides mayor: por debajo de espina escapular. Musculo romboides menor: por encima de espina escapular.
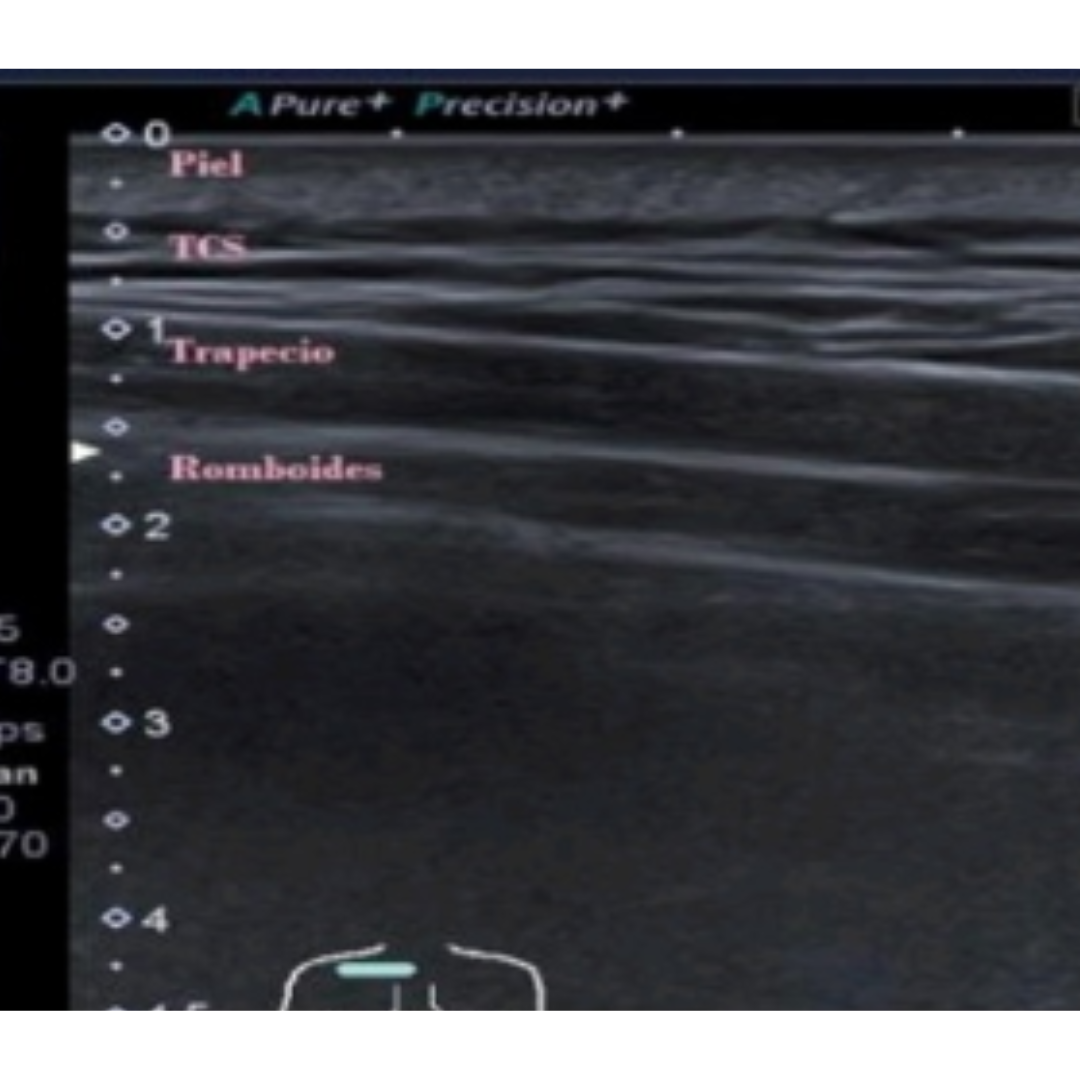
Imagen 5: Los romboides se pueden encontrar entre la columna vertebral y el borde medial de la escápula bajo el trapecio. De superficial a profundo: piel - tejido celular subcutáneo – trapecio – romboide.
MÚSCULOS INTERCOSTALES INTERNO Y EXTERNO
Son 11 pares de músculos que se encuentran ubicados entre las costillas.
Origen: Interno: surco costal de la costilla. Externo: borde caudal externo de la costilla
Inserción: Interno: borde superior de la costilla inferior. Externo: borde craneal externo de la costilla subyacente.
Imagen 6: Corte longitudinal al cuerpo pero transversal a las costillas 6ta y 7ma. IE: intercostal externo. II: intercostal interno. Flechas pequeñas indican línea pleuropulmonar.
MÚSCULO SERRATO ANTERIOR Y POSTERIOR
Ubicados en la pared torácica anterior hacia lateral, pero existe también un grupo ubicado por posterior -superior entre la columna y la escápula, un grupo inferior entre la columna y las costillas inferiores.
Origen: Anterior: fascia intercostal (costillas 1 a 8/9). Posterior: por superior en vértebras cervicales y por inferior torácicas inferiores.
Inserción: Anterior: escápula. Posterior: costillas superiores e inferiores.
Imagen 7: A) Visión anterior musculo Serrato(S), Músculo pectoral mayor(Pma), musculo pectoral menor (Pme) B) región costal anterior de superficial a profundo: piel – tejido subcutáneo – pectoral mayor – pectoral menor – serrato anterior – costillas – pleura pulmonar
Cabe mencionar que existen bastantes músculos en la pared torácica, pero no todos se logran evaluar ecográficamente de forma clara y sencilla como son los músculos: infraclavicular, transverso del tórax y elevador de la escápula. Otros como el músculo supraespinoso e infraespinoso en la escápula también se pueden visualizar durante el estudio hacia craneal y a caudal de la espina escapular, respectivamente.
Conclusión
Conocer la inserción y planos musculares que se encuentran cercanos a la región mamaria es relevante para lograr caracterizar lesiones, describir detalladamente su ubicación y es un conocimiento necesario para aquellos profesionales especialistas en ecografía mamaria que no realizan ecografía musculoesquelética, pero que día a día se ven enfrentados a casos donde los pacientes señalan sintomatología profunda o adyacente a la mama.
Referencias
Smereczynski, A., Kolaczyk, K. & Bernatowicz, E. (2017). Chest Wall – underappreciated structure in sonography. Part I: Examination methodology and ultrasound anatomy. DOI: 10.15557/JoU.2017.0029
Ventura, L. (s.f.). Manual de Ecografía Muusculoesquelética. Editorial Panamericana.
Torres, P. Blázquez, S, Barcina, E., et al (s.f.). Papel de la imagen (ecográfica y RM) en las lesiones traumáticas del pectoral mayor. SERAM
Kenhub. (s.f). Músculo Trapecio. Músculo Serrato Anterior.
UGR (s.f.). Pectoral Mayor. Pectoral Menor.
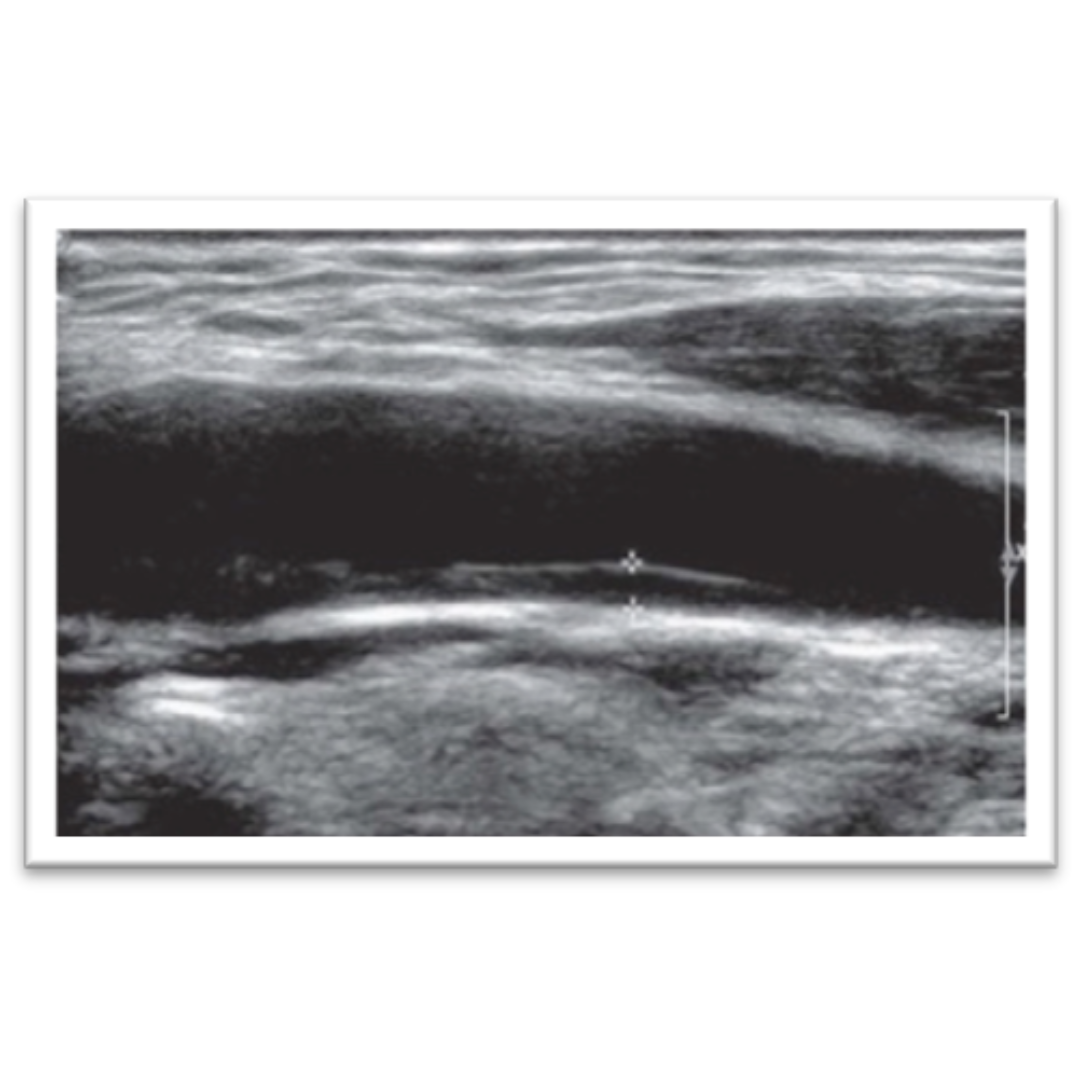
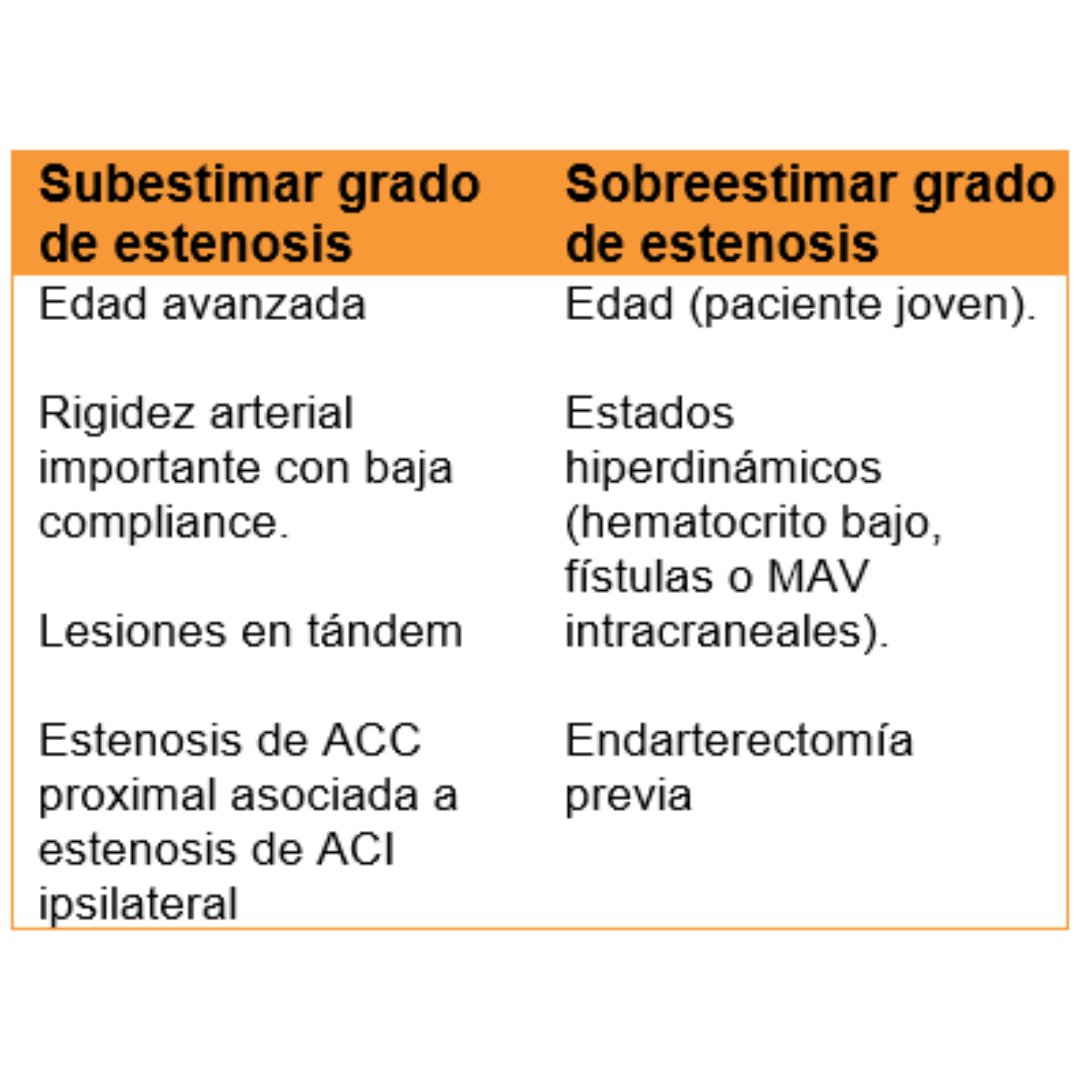
Estenosis de Arteria Carótida Interna: Mediciones Ecográficas Recomendadas
TM Montserrat Acevedo - TM Elizabeth Vidal - TM Cristian Moya
Resumen
El Doppler carotídeo es la técnica comúnmente usada para evaluar el grado de estenosis de la arteria carótida interna (ACI), siendo ACI el marcador más relevante de riesgo de ictus y sobre el que se basa la decisión de Re permeabilizar esta arteria, por este motivo es que conocer las mediciones que nos ayudan a precisar el porcentaje de estenosis es fundamental, a continuación revisaremos signos directos e indirectos involucrados en determinación de estenosis de ACI.
Imagen 1: Exploración ecográfica en Doppler color de los troncos arteriales supraaórticos. A) Imagen axial en Doppler color obtenida en la zona de bifurcación, que demuestra la localización y las características Doppler color de la arteria carótida interna y de la arteria carótida externa, con presencia de flujo laminar, sin turbulencias, ni presencia de engrosamientos intímales ni placas de ateroma. B) Imagen axial en Doppler color de la arteria carótida común (ACC) C) Imagen axial en Doppler color del tronco braquiocefálico. D) Imagen sagital en Doppler color de la arteria carótida común (ACC), la arteria carótida interna (ACI) y la arteria carótida externa (ACE).
Parámetros para analizar en el estudio de la estenosis carotídea
Se mencionan parámetros directos e indirectos (Tabla1), los directos son los relacionados a la estenosis carotidea:
Signos directos: Cambios de velocidad en el punto de mayor estenosis.
Velocidad sistólica máxima (VSM).
Velocidad diastólica final (VDF).
Los cambios indirectos son todos aquellos que se generan por la estenosis carotidea:
Signos indirectos: Cambios hemodinámicos en:
Arteria carótida común (ACC).
Segmento post-estenótico de la ACI extracraneal.
Circulación intracraneal.
Los métodos de medición para una estenosis carotídea son:
Evaluación con Doppler color y Dúplex.
Imágenes de pared arterial, en longitudinal y transversal.
Medición de grosor íntima-media de carótida común.
Existencia y localización de placas de ateroma.
La estenosis detectada se debe medir basándose en signos directos e indirectos y no en función de la disminución del área o del lumen arterial.
Ángulo de incidencia paralelo a la dirección del flujo, sin superar un ángulo de 60°.
Determinar VSM y VDF en el punto de máxima estenosis.
Determinar VSM y VDF de la ACC.
En sospecha de estenosis ≥ 50%, siempre se deben evaluar signos indirectos (segmento extracraneal post-estenótico de la ACI, la arteria oftálmica y las arterias intracraneales).
magen 2: Valoración del grosor intima-media de la arteria carótida común. Un grosor de 1 mm es considerado dentro de lo normal, mayor a 1,5 mm se considera placa de ateroma.
En la tabla 2 se mencionan. “Cálculos de índices hemodinámicos más frecuentes para estenosis carotidea” descritos en por la sociedad española de neurología . Estos son útiles en casos donde la VSM y VDF no representa correctamente el grado de estenosis arterial, como son las lesiones en tándem, estenosis contralateral de alto grado, bajo gasto cardíaco, estado circulatorio hipodinámico (fiebre, anemia), etc.
Estenosis de arteria carótida interna de 70% a 79%
Es el punto de corte clínicamente relevante, ya que sobre 70% se realiza tratamiento de revascularización. En estos casos debemos medir signos directos e indirectos para establecer un resultado confiable. Si bien, cada centro puede tener sus propios valores normales, lo habitual es que un VSM >230cm/s corresponda a una estenosis >70% con este grado de estenosis el flujo cerebral permanece normal.
Imagen 3: Estenosis > 70% de la arteria carótida interna izquierda. La ecografía dúplex de la arteria carótida interna muestra una VSM elevada (369 cm/s) y turbulencia del flujo en Doppler color inmediatamente distal al segmento estenótico, con ensanchamiento espectral y una velocidad telediastólica elevada (141 cm/s).
Problemas al interpretar y en diagnóstico
Existen casos donde la evaluación de velocidades y Doppler color podrían verse afectados, estos casos son frecuentemente por la existencia de placas extensas calcificadas en el bulbo carotídeo, las que generan sombra acústica e impiden la evaluación del punto de mayor estenosis.
Cuando se sospecha una oclusión carotídea, y en pacientes sintomáticos con estenosis entre 50-70%, su diagnóstico debe basarse en evaluar los signos indirectos proximales y distales, además de patrones hemodinámicos transcraneales.
Entre los problemas que generan subestimación o sobreestimación del grado de estenosis, destacan:
Estenosis de ACI tras endarterectomía o Stent carotídeo
El 10% de los pacientes tratados presentarán una reestenosis. Los criterios de velocidad habituales sobreestiman el grado de estenosis en pacientes tratados, por lo que será necesario aplicar un factor de corrección, aproximadamente de un 20%.
Conclusión
El estudio de las arterias carótidas con Doppler Color y espectral es una técnica útil, y es el método diagnóstico inicial ante sospechas de accidente cerebrovascular.
La realización del examen se debe realizar respetando los factores técnicos Doppler, principalmente el ángulo Doppler, además de basarse en los signos directos e indirectos.
La obtención sólo de parámetros ecográficos directos, como la VSM o la VDF, no son suficientes para ofrecer un diagnóstico fiable del grado de estenosis carotídea, por lo que, la consideracion de factores indirectos aumentan la confiabilidad del examen, permitiendo cuantificarlo con precisión.
Referencias
Beach KW, Bergelin RO, Leotta DF, Primozich JF, Sevareid PM, Stutzman ET, et al. Standardized ultrasound evaluation of carotid stenosis for clinical trials: University of Washington Ultrasound Reading Center. Cardiovasc Ultrasound. 2010;8:39.
Consenso de estenosis carotídea. Sociedad Argentina de Cardiología. Sociedad Neurológica Argentina. Revista Argentina de Cardiología 2006; 74(2).
González, A., Arrieta, T., Solís, L., Pérez, M., & Ramírez, M. R. (2009). Estudio con ultrasonido doppler color en la caracterización de la enfermedad aterosclerotica carotidea oclusiva sintomatica. Revista chilena de radiología, 15(3), 110-121.
Grant EG, Benson CB, Moneta GL, Alexandrov AV, Baker JD, Bluth EI, et al. Carotid artery stenosis: gray-scale and Doppler US diagnosis--Society of Radiol- ogists in Ultrasound Consensus Conference. Radiology. 2003;229:340-6.
Gunduz, Y., Akdemir, R., Ayhan, L. T., & Keser, N. (2014). Can Doppler flow parameters of carotid stenosis predict the occurrence of new ischemic brain lesions detected by diffusion-weighted MR imaging after filter-protected internal carotid artery stenting?. American Journal of Neuroradiology, 35(4), 760-765.
Jahromi AS, Cinà CS, Liu Y, Clase CM. Sensitivity and specificityof color duplex ultrasound measurement in the estimation ofinternal carotid artery stenosis: a systematic review and meta-analysis. J Vasc Surg. 2005;41:962—72.
Serena J, Irimia P, Calleja S, Blanco M, Vivancos J, Ayo-Martín O. Ultrasound measurement of carotid stenosis: recommendations from the Spanish Society of Neurosonology. Neurologia. 2013;28:435-42.
Von Reutern GM, Goertler MW, Bornstein NM, Del Sette M, EvansDH, Hetzel A, et al. Grading carotid stenosis using ultrasonicmethods. Stroke. 2012;43:916—21.
Nódulos Tiroideos Degenerativos: Evaluación Ecográfica
TM Scarlette Contreras - TM Cristian Moya - TM Elizabeth Vidal
Resumen
Los nódulos degenerativos (ND) son de complejo diagnóstico, requieren experiencia ecográfica y también conocer acabadamente los antecedentes e historia clínica del paciente, por lo que contar con estudios anteriores es fundamental. Los ND son un desafío, ya que presentan hallazgos ecográficos sospechosos. En las punciones con aguja fina (PAAF), los resultados obtenidos son variados, desde benignidad, atipia de significado incierto hasta resultados no diagnósticos, aumentado así la repetición de biopsias o cirugías por resultados inciertos.
Introducción
Los nódulos degenerativos (ND) pueden ser:
Nódulos quísticos o predominantemente quísticos: donde su porción quística puede ser absorbida y/o desecada generando la una reducción de tamaño.
Nódulos sólidos: sufren hemorragias o trombosis que pueden ser inducidas posterior a biopsias o espontáneas. Este suministro sanguíneo deficiente (por trombosis o hematoma post hemorragia) lleva más tarde a un proceso de degradación y reducción de tamaño.
Bajo ecografía, los ND pueden presentar características sospechosas que son necesarias de diferenciar de nódulos malignos, para evitar una PAAF que muchas veces no será categórica.
Caso 01: Nódulo en control a) diciembre 2007 nódulo coloideo predominantemente quístico b) diciembre 2010 nódulo en degeneración, muestra un nódulo sólido hipoecoico con focos ecogénicos.
Desarrollo
Es recomendable realizar ecografías de control para evidenciar los diferentes cambios que muestran los nódulos degenerativos, y disminuir la repetición de biopsias o cirugías por resultados poco concluyentes.
Se ha demostrado que, en ecografía los ND:
Son nódulos quísticos o predominantemente quísticos, que pierden su porción quística reduciendo su tamaño y quedando sólo su porción sólida visible.
Aumentan la detección de características sospechosas, como la hipoecogenicidad por la fibrosis, debido a la reducción de tamaño, y los márgenes espiculados, por el colapso o distorsión capsular.
En ellos, aumenta la presencia de micro y macro calcificaciones, con la reducción del tamaño nodular.
Pueden presentar forma más alta que ancha en ultrasonido, lo que se relaciona con una tracción fibrosa asimétrica por su degeneración.
Pueden presentar un borde isoecogénico continuo y fino, que abarca más de la mitad del nódulo (que corresponde a la pared del nódulo quístico previo a la degeneración), o un halo hipoecogénico.
Pueden presentar sombra acústica posterior, asociada a una interfaz desigual, debido a encapsulamiento o fibrosis periférica.
Caso 02: a) Nódulo solido heterogéneo con halo hipoecogénico. b) control a los 3 años siguientes, evidenciando una disminución notoria en su tamaño.
Caso 03: Seguimiento de un nódulo sólido, hipoecogénico, con imágenes hiperecogénicas en su interior. a) inicial b) 4 meses después c) 6 meses después, evidenciando una disminución progresiva de su tamaño.
Recomendaciones
Es posible minimizar los procedimientos innecesarios para los pacientes tomando en cuenta algunas recomendaciones:
Se recomienda primero una ecografía de seguimiento para establecer si existen cambios en el nódulo.
En el caso de no contar con imágenes previas, o que en los controles posteriores el nódulo siga siendo altamente sospechoso, se debe recomendar una biopsia.
La PAAF puede ser la primera opción, pero los ND tienden a presentar resultados benignos, atipia de significado indeterminado, o resultados no diagnósticos.
En casos de resultados inciertos en la PAAF se recomienda realizar una biopsia con aguja gruesa, en lugar de repetir la PAAF, para evitar una cirugía innecesaria ante otro resultado incierto.
Discusión
El aporte de exámenes previos y antecedentes clínicos son fundamentales para evitar un estudio histológico, también es importante relacionar la edad del paciente. Se entiende que pacientes mayores a 40 años tienen mayor probabilidad de presentar ND que los pacientes jóvenes. El antecedente de punción previa aumenta la probabilidad de encontrar ND. Además, el seguimiento ecográfico visualizando detalladamente los exámenes previos, sumado al conocimiento ecográfico podrían ser de gran aporte en los pacientes.
Referencias
Ren J, Baek JH, Chung SR, Choi YJ, Jung CK, Lee JH. Nódulos tiroideos degenerativos: diagnóstico por ultrasonido, importancia clínica y tratamiento. Korean J Radiol. 2019 junio;20(6):947-955. https://doi.org/10.3348/kjr.2018.0599
López García, M. D. C., Alfaro Martínez, J. J., García Angel, R. D., López Martínez, L. M., & Sirvent Segovia, A. E. (2020). Infarto hemorrágico espontáneo de nódulo tiroideo. Journal of Negative and No Positive Results, 5(9), 1059-1062. https://dx.doi.org/10.19230/jonnpr.3505
Lesiones benignas simuladoras de Cáncer Mamario: Diagnósticos diferenciales y sus signos ecográficos
TM María Jesús Catalán, TM Elizabeth Vidal, TM Cristian Moya
Introducción
Existe un gran número de lesiones benignas en la mama que pueden “disfrazarse” de malignas. El conocer las características ecográficas, síntomas y signos del paciente, así como sus antecedentes, nos permitirán diferenciarlas de verdaderos casos malignos, evitando el estudio histopatológico. Sin embargo, en algunos casos este paso será imposible de evitar.
Tumor Filodes
Procede del estroma mamario intralobulillar y se compone de tejido conectivo y epitelial. Su presentación más habitual es como un nódulo sólido, palpable, de crecimiento rápido.
Al ultrasonido (US): Nódulo bien definido, de contorno liso o lobulado, ligeramente hipoecogénico, de aspecto sólido con buena transmisión posterior del sonido. Su interior se puede observar homogéneo o heterogéneo por degeneración quística, hemorragia o necrosis.
Diagnostico Diferencial (DD): Tumor filodes maligno es de rápido crecimiento con bordes irregulares y aumento de la señal al Doppler.
Imagen 1: Dos diferentes casos de tumor filodes
Adenoma del Pezón
Se origina en los ductos del pezón y se manifiesta por telorrea, prurito, eritema, erosión o nodularidad, puede ser asintomático también.
Al US: masa lobulada u oval, homogénea, iso o hipoecogénica en el pezón, con incremento en la vascularidad en Doppler.
DD: carcinoma ductal, en casos sospechosos se realiza biopsia para determinar atipia de la lesión.
Imagen 2: Se observan en la región retroareolar derecha dos nódulos sólidos intraductales de 2 y 6 mm, que muestran vascularidad periférica a la aplicación Doppler color.
Adenosis Esclerosante
Es una lesión proliferativa más frecuente en la perimenopausia, se presenta como mastalgia inespecífica e incluso como un bulto palpable. Es hallazgo incidental.
Al US: imagen nodular de morfología irregular, no paralela, puede generar tenue sombra acústica posterior.
DD: lesión altamente sospechosa de malignidad al tener características ecográficas de malignidad, comúnmente se necesita una biopsia para confirmar o descartar diagnóstico.
Imagen 3: Imagen nodular de morfología irregular que genera leve sombra acústica posterior, clasificada como BI-RADS 4b.
Galactocele
Se origina por obstrucción de conducto excretor de leche.
Al US: es variable pueden ser desde ovalados, circunscritos, hipoecogénicos, heterogéneos, sin características posteriores hasta irregulares, no circunscritos, hiperecogénicos, sólidos, con refuerzo o sombra posterior, etc.
DD: al tener presentación variable puede llegar a confundirse con una lesión sugestiva de malignidad, en esos casos se necesita una punción aspirativa con aguja fina (PAAF), para determinar el contenido de la lesión.
Imagen 4: Colección hipoecogénica bien delimitada con contenido móvil ecogénico espeso y vascularización ausente en la exploración Doppler, dentro de la mama lactante que mostraba conductos retro y periareolares prominentes. La aspiración reveló un líquido lechoso.
Mastitis Granulomatosa
Enfermedad inflamatoria crónica benigna de etiología desconocida y generalmente es un diagnóstico de exclusión. Comúnmente se presenta como masa dolorosa unilateral, acompañada de edema cutáneo y/o eritema.
Al US: es variable, es más frecuente una gran masa hipoecogénica heterogénea irregular con múltiples extensiones tubulares, mayormente paralela, en ocasiones masas lobuladas o irregulares o incluso circunscrita hipoecogénica, también puede o no tener características posteriores. También puede tener señal al Doppler por el proceso inflamatorio y engrosamiento de la piel.
DD: carcinoma inflamatorio, al diagnosticarse por exclusión debe ser estudiada bajo histopatología.
Imagen 5: US de mama izquierda que evidencia una formación mixta sólido-quística con extensión ductal.
Cicatriz Radiada
Antes conocida como esclerosis papilar proliferativa, epiteliosis infiltrativa o lesión esclerosante encapsulada. Es una lesión proliferativa con fibroelastosis central y apariencia espiculada radiográfica e histológicamente.
Al US: distorsión de la arquitectura sin nódulo asociado, ecoestructura heterogénea y sombra acústica posterior; si se detecta nódulo espiculado se asocia con mayor malignidad.
DD: carcinoma invasor o intraductal, son lesiones que se clasifican como BI-RADS 4 por lo que se estudian mediante biopsia.
Imagen 6: B: distorsión de la arquitectura con espículas radiadas largas que confluyen centralmente. C: zona de distorsión de la arquitectura retroareolar.
Hematomas
Son colecciones de sangre que se forman como resultado de una hemorragia en el espesor del tejido, generalmente como consecuencia de un traumatismo. Se presentan como tumoración mamaria post traumatismo y comúnmente se asocia a equimosis.
Al US: se pueden observar cómo colecciones líquidas hipoecogénicas, colecciones quísticas complejas y heterogéneas e incluso como masas sólidas.
DD: sangrado intratumoral, es necesario biopsia para descartar que sea producto de una neoplasia mamaria maligna.
Imagen 7: Las imágenes muestran una masa heterogénea y no circunscrita, con refuerzo acústico posterior. La imagen B muestra el flujo Doppler en periferia.
Mastopatía Diabética
Aparece en aproximadamente en el 13% de las diabéticas insulinodependientes de larga data. Es una lesión mamaria fibroinflamatoria, su causa es desconocida.
Al US: presencia de nódulos o áreas nodulares sólidas irregulares, mal definidas, con importante atenuación acústica posterior
DD: puede simular carcinomas lobulares. Para diferenciar es común la evaluación por resonancia nuclear magnética (RNM), y posteriormente realizar biopsia.
Imagen 8: Ecografía con área heterogénea sólida hipoecogénica en CSE de mama izquierda de 20 mm.
Necrosis Grasa
Proceso inflamatorio y no supurativo que se origina por una lipolisis. Su sintomatología es diversa desde mastodinia, aumento de volumen, alteraciones en la piel, etc. Comúnmente es producto de un traumatismo o intervención quirúrgica.
Al US: su apariencia es variable, puede ser similar a un quiste complejo, con particulado interno, niveles grasa-líquido y calcificaciones en suspensión o en la pared, pero también puede presentarse como una lesión sólida con sombra acústica posterior.
DD: cuando se presenta como una lesión sólida, puede impresionar maligna, en esos casos se recomienda estudiar histopatológicamente.
Imagen 9 y 10: Ejemplos de necrosis grasa.
Hiperplasia Atípica
Es la acumulación en los conductos y lóbulos mamarios de células atípicas, es un factor de riesgo para desarrollar cáncer.
Al US: no tiene un patrón propio, cuando se halla en la zona central de la mama puede observarse una alteración difusa e inespecífica de la unidad funcional, ductos y Unidad Ducto- Lobulillar Terminal (UDLT), y ocasionalmente, se pueden visualizar directa o indirectamente microcalcificaciones.
DD: carcinoma, es necesario confirmar hipótesis diagnóstica con biopsia.
Imagen 11: A y B Lesión hipoecogénica de margen irregular y orientación antiparalela, que en la mamografía se corresponde con una densidad focal asimétrica en CSE, con diagnóstico de hiperplasia ductal atípica. C y D masa ovalada, hipoecogénica de margen angulado, que en mamografía se asociaba a microcalcificaciones pleomórficas, con diagnóstico de hiperplasia ductal atípica.
Discusión
La caracterización y conocer el diagnóstico diferencial de estas lesiones atípicas es importante para apoyar en el manejo clínico, considerando que son lesiones que tienen características malignas e incluso algunas de ellas, como es el caso de la hiperplasia atípica, pueden progresar a lesiones malignas. El rol del ultrasonido es en muchos casos realizar seguimiento estricto de la imagen y en otros evitar el estudio histopatológico.
Referencias
Tamayo, E., Cornelio, G., Ortiz, M. & Rodríguez, A. (2020). Cicatriz radial, lesión proliferativa benigna de la mama. Acta Med Número 2. DOI: 10.35366/9390
Barco-Manrique, J., Jaramillo, N., Ochoa-vera, M., et.al. (2021). Mastitis granulomatosa: un reto radiológico. Revista chilena de radiología vol. 27 no.3. DOI: 10.24875/RCHRAD.M210000002
Hernanz, A., Lobato, J., Sánchez, M., et.al. (2014). Hematoma de mama que simula un cáncer y cáncer de mama que debuta con hematoma.Elsevier. Vol. 41. Núm. 2. Páginas 83-85. DOI: 10.1016/j.gine.2013.05.002
Stavros. (2006). Ecografia de Mama. A. Thomas Stavros, Editorial Marbán Libros.
Sales, J., Blanc, E., Medina, R., et.al. (s.f.). Ecografía con contraste intravenoso en la patología mamaria aguda no tumoral. Seram.
Mysler, D., Sarquis, F., Castro, M., et.al. (2009). Imágenes en mastopatía diabética. Revista Chilena de Radiología Vol.15 no.4
Acevedo, D., López, Y., Pascual, C., et.al. (s.f.). Correlación radio-patológica y seguimiento de las lesiones mamarias histológicas de alto riesgo en nuestro hospital. Seram.
Lanfranchi, M. & Gori, R.E. (2020). Eco de mama. Marbán. ISBN:978-84-18068-02-7
Gutiérrez, A., Sánchez, D., Fernández, A., et.al. (s.f.). Hallazgos radiológicos de la necrosis grasa de la mama: un atlas. Seram.
Adel, R. (s.f.). Galactocele. Radiopaedia.org. Recuperado de: https://radiopaedia.org/cases/galactocele-8#image-61296113
Tcholakia, L., Barbi, M. (s.f.)- Falsos positivos de la ecografía mamaria. Diagnóstico Rojas N° 524.
Dávila-Zablah, Y., Barrios-Ruiz, A., Gómez-Macías, G., et. al. (2019). Adenoma del pezón: reporte de un caso. Anales de Radiología México.
Lesiones del Ligamento Colateral Cubital del Pulgar: Más que lesión de Stener
Detalles anatomopatológicos del ligamento colateral cubital en el pulgar y sus presentaciones
TM Bastián Muñoz / TM Elizabeth Vidal / TM Cristian Moya
Introducción
La articulación metacarpofalángica (MTC-F) del pulgar frecuentemente recibe lesiones y por consiguiente el ligamento colateral cubital (LCC), en donde la importancia de la correcta visualización y demostración de sus afecciones puede cambiar el diagnóstico y tratamiento del paciente, pasando de un tratamiento no invasivo a un tratamiento quirúrgico en el caso de lesión de Stener.
Anatomía
Anatómicamente la articulación está compuesta por una placa palmar y por ligamentos colaterales. Los ligamentos colaterales radial y cubital, van a estabilizar la articulación. El ligamento colateral se compone de dos porciones una propia y otra accesoria. La porción propia evita la desviación lateral en la flexión y la accesoria la desviación frontal en la extensión. El LCC en particular posee estrecha relación con la aponeurosis dorsal del musculo aductor del pulgar dado que es recubierto por este.
Mecanismo de lesión
Las lesiones de LCC se producen por la hiperextensión o abducción especialmente en caídas, siendo frecuentes en personas que realizan actividades como esquí o skate. La patología tiende a recibir el nombre; “dedo de esquiador”.
Se caracteriza clínicamente por el dolor al movimiento del pulgar, puede tener eritema o inestabilidad de la articulación como también dolor al agarrar objetos utilizando el dedo pulgar.
Esguince del LCC
Ecográficamente el ligamento LCC en un esguince se verá:
· Engrosado.
· Hipoecogénico.
· Heterogéneo
· Con aumento de señal Doppler.
· Puede asociarse a sinovitis MTC-F.
Es de importancia comparar con ligamento contralateral.
Rotura con avulsión
Se observan los signos de esguince sumado a imagen hiperecogénica puntiforme en porción proximal del ligamento compatible con fragmento óseo de la cabeza del Metacarpo, asociado a área hipoecogénica (flecha amarilla) sugerente de rotura parcial, no se evidencia una retracción significativa del ligamento.
Rotura completa
El ligamento se evidencia con signos de esguince, pero además con un área hipoecogénica que demuestra la perdida de continuidad de sus fibras. Es importante su demostración dinámica con movimientos de flexo-extensión o de hiperabducción demostrando la movilidad de los cabos.
Lesión de Stener
Rotura total del LCC con retracción de cabo proximal que resulta en la interposición de la aponeurosis del músculo aductor corto del pulgar entre el LCC y la art MTC-F. Ecográficamente se visualiza:
· Imagen pseudonodular correspondiente a cabo del ligamento retraído.
· Visualización de la aponeurosis del aductor corto entre la art MTC-F y el cabo del LCC.
· Maniobra dinámica de flexo-extensión comprueba interposición de aponeurosis.
Discusión
Las maniobras dinámicas juegan un papel fundamental para poder caracterizar la patología, demostrar la extensión y clasificar las lesiones del LCC. En el caso de la Lesión de Stener el estudio dinámico es clave para lograr demostrar la interposición de la aponeurosis del M aductor corto del pulgar o bien para descartar esta lesión, ya que la ecografía nos permite evaluar la correcta movilidad de la aponeurosis incluso en casos no patológicos.
Referencias
Melville, D. M., Jacobson, J. A., & Fessell, D. P. (2014). Ultrasound of the Thumb Ulnar Collateral Ligament: Technique and Pathology. American Journal Of Roentgenology, 202(2), W168. https://doi.org/10.2214/ajr.13.11335
Bianchi, S., & Martinoli, C. (2007). Ultrasound of the Musculoskeletal System. Springer Science & Business Media.
Jiménez Díaz, J. F. (2017). Eco Musculoesquelética (1.a ed., Vol. 3).
Maulik S Patel, Radiopaedia. https://radiopaedia.org/cases/171380/play?lang=us
¿Cómo diferenciar las lesiones polipoideas de la vesícula biliar?
Autores: TM Evelyn Roco / TM Elizabeth Vidal / TM Cristian Moya
Introducción
Revisión descriptiva de los de pólipos vesiculares más y menos frecuentes. Los pólipos de la vesícula biliar son proyecciones de la mucosa hacia la luz de alguna de sus capas, no móviles y sin sombra acústica posterior.
Objetivos
Describir el espectro de lesiones polipoideas de la vesícula biliar. Enumerar las características destacadas para un buen diagnóstico diferencial.
Pseudotumores
Adenomatosis: Implica una hiperplasia de la capa mucosa como muscular, es una acumulación de colesterol que contiene cristales o cálculos. Son ecogénicos con artefacto de centelleo o de cola de cometa.
Pólipos de colesterol: Es un depósito de triglicéridos y ésteres de colesterol dentro de macrófagos en la lámina propia cubierto por epitelio normal. Son ecogénicos, sin sombra acústica.
Pólipos inflamatorios: Es causado por el depósito crónico de colesterol y posterior de la mucosa, lo que forma granulación y tejido fibroso, en ecografía tienen un aspecto inespecífico, general <10mm.El diagnóstico es histopatológico.
Tumores
Adenomas: Puede aparecer como una masa pediculada o sésil (hasta 20 mm), con espacios quísticos e hipoecoicos en la pared, con ecos brillantes y en cola de cometa, puede estar vascularizado.
Adenocarcinoma: Es la lesión polipoidea maligna más común, múltiples estudios lo asocian a cálculos biliares y a la “ vesícula en porcelana” .El adenocarcinoma biliar se clasifica en múltiples subtipos, el más común es el papilar. Se presenta como un engrosamiento focal de la pared vesicular (mayor a 3 mm), vascularizado al Doppler color.
Mimics
Barro tumefacto
Lesiones hiperecogénicas con movimiento lento al cambio de posición, están adheridos a la pared, sin sombra ni señal al Doppler color.
Litiasis adheridas
Litiasis vesiculares no móviles ya sea por localización (usualmente fondo), o por su gran tamaño. De escasa sombra acústica posterior.
Barro biliar con adenomiomatosis
Contenido ecogénico con artefactos centelleantes causados por cristales de colesterol en el barro biliar y la pared de la vesícula biliar.
Infrecuentes
Enfermedad metastásica
En occidente el principal tumor que metastatiza la vesícula es el melanoma, y en oriente es el carcinoma gástrico. Los cánceres de riñón y pulmón pueden ser hematógenos. Mientras que el carcinoma hepatocelular y el colangiocarcinoma pueden invadir directamente la vesícula biliar.
Tratamiento
Discusión
Las imágenes juegan un papel fundamental en la evaluación de los pólipos vesiculares, por lo que lo signos ecográficos como tamaño, engrosamiento de pared, base ancha y litiasis coexistentes entre otros, acompañado de la información del paciente (edad, factores de riesgo de cáncer vesicular) definirán la conducta clínica.
Referencias
1.Myers RP, Shaffer EA, Beck PL. Gallbladder polyps: epidemiology, natural history and management. Can J Gastroenterol 2002;16(3):187–194.
2. Lee KF, Wong J, Li JC, Lai PB. Polypoid lesions of the gallbladder. Am J Surg 2004;188(2):186–190. Figure 12. Flowchart shows the best practice algorithm for management of gallbladder (GB)
3. Terzi C, Sökmen S, Seçkin S, Albayrak L, Uğurlu M. Polypoid lesions of the gallbladder: report of 100 cases with special reference to operative indications. Surgery 2000;127(6):622–627.
4. Jørgensen T, Jensen KH. Polyps in the gallbladder: a prevalence study. Scand J Gastroenterol 1990;25(3):281–286.
5. Andrén-Sandberg A. Diagnosis and management of gallbladder polyps. N Am J Med Sci 2012;4(5):203–211.
6. R. Vialle, J. Sellier, S. Velasco, J.-P. Faure, J.-P. Richer, J.-P. Tasu; Poitiers/FR Gallbladder tumors: What radiologists need to know ECR 2010 / C-0015 10.1594/ecr2010/C-0015
Clasificación ecográfica de lesión de cabeza medial de gastrocnemio
Autor TM Montserrat Acevedo
Resumen
Se propone una clasificación de la lesión de cabeza medial de gastrocnemio (GN), conocida como pierna de tenista, basada en hallazgos ecográficos y relacionarlo con el tiempo de regreso al trabajo (RTW) o regreso al deporte (RTS), evaluando su pronóstico.
Introducción
Es una lesión común, especialmente en atletas.
Rotura que afecta a la unión miotendinosa (UMT) del GN medial que se produce por extensión abrupta de la rodilla, generando una contracción activa y un estiramiento pasivo del GN,
Síntomas:
- Dolor agudo en región posterior de pierna.
- Sensación de chasquido.
- Como si recibiera un piedrazo en la zona.
Resultados
Lesión Tipo 1
A nivel de UMT de gastrocnemio medial. Alteración de ecoestructura muscular sin retracción de las fibras musculares, aponeurosis de gastrocnemio (GA)intacto. No es común ver hematoma, movimiento sincrónico GN/S.
Lesión Tipo 2
Interrupción de GA, con retracción de fibras musculares, asociado a hematoma intermuscular.
Tipo 2a: Rotura menor a 50% de GA, movimiento sincrónico GN/S.
Tipo 2b: Rotura mayor a 50% de GA, movimiento asincrónico GN/S.
Lesión Tipo 3
Interrupción distal a aponeurosis libre FGA, con engrosamiento fusiforme distal. No se relaciona a hematoma intermuscular, puede presentar movimiento asincrónico GN/S.
Lesión Tipo 4
Lesión mixta, involucrando a GA y FGA. Retracción de fascículo muscular del GN, se observa muñón distal hipertrófico. Asociado a hematoma intermuscular y movimiento asincrónico GN/S.
Discusión
Con el aumento del grado de la lesión hubo un aumento significativo de RTP / RTW. El músculo GN tiene una UMT periférica, cuando se rompe la aponeurosis se genera un hematoma que disecciona el espacio interaponeurótico entre GN y sóleo. La lesión tipo 2 fue la más frecuente, donde el examen dinámico cumple un rol fundamental al diferenciar el tipo 2a del 2b, donde la última tiene una RTP / RTW más larga. Las lesiones con peor pronóstico (tipo 3 y 4) que se asocian a tejido tendíneo, son más comunes en atletas, ya que necesitan una mayor fuerza para que ocurran. La lesión de GA (tipo 2 y 4) se asocian a hematoma intermuscular.
Las lesiones de FGA se asocian a equimosis distal en EEII. La clasificación propuesta es concordante en principios generales con la clasificación BAMIC, uno de los sistemas más utilizados y aceptados.
Referencias
Powell RW., 1883 / Arner O, Lindholm A., 1958 / Miller WA.,1977 / Ekstrand J, Hägglund M, Waldén M., 2011 / Domeracki SJ, Landman Z, Blanc PD, Guntur S., 2019 / Mueller-Wohlfahrt H-W, Haensel L, Mithoefer K, et al., 2013 / Pollock N, James SLJ, Lee JC, Chakraverty R., 2014 / Valle X, Alentorn-Geli E, Tol JL, et al., 2017 / Chow RS, Medri MK, Martin DC, Leekam RN, Agur AM, McKee NH., 2000 / Balius R, Alomar X, Rodas G, et al., 2013 / Blitz NM, Eliot DJ., 2007 / Dalmau-Pastor M, Fargues-Polo B, Casanova-Martínez D, Vega
J, Golanó P., 2014 / Delgado GJ, Chung CB, Lektrakul N, et al., 2002 / FC Barcelona Muscle Injuries Clinical Guide 3.0., 2015 / Bianchi S, Martinoli C., 2007 / Bianchi S, Martinoli C, Abdelwahab IF, Derchi LE, Damiani S., 1998 / Flecca D, Tomei A, Ravazzolo N, Martinelli M, Giovagnorio F., 2007 / Macdonald B, Mcaleer S, Kelly S, Chakraverty R, Johnston M, Pollock N., 2019 / Comin J, Malliaras P, Baquie P, Barbour T, Connell D., 2013 / Prakash A, Entwisle T, Schneider M, Brukner P, Connell D., 2018 / Valle X, Tol JL, Hamilton B, et al., 2015 / Brukner P, Nealon A, Morgan C, Burgess D, Dunn A., 2014 / Pedret C, Rodas G, Balius R, et al., 2015 / Patel A, Chakraverty J, Pollock N, Chakraverty R, Suokas AK, James SL., 2015 / Bright JM, Fields KB, Draper R., 2017 / Das GH., 1999 / Järvinen TAH, Järvinen TLN, Kääriäinen M, Kalimo H, Järvinen M., 2005 / Balius R, Alomar X, Pedret C, et al., 2018 / Ryan A., 1969 / Balius R, Blasi M, Pedret C, et al., 2020 / Garrett WE., 1996 / Tempfer H, Traweger A., 2015.